Гемоглобин содержащие продукты: Продукты, повышающие гемоглобин в крови: какие содержат больше железа
РазноеПродукты повышающие гемоглобин – Какие продукты повышают гемоглобин
«Ба-а, деточка, да у вас низкий гемоглобин!» Эту фразу хотя бы раз в жизни слышала каждая женщина. И любому из нас сразу становится ясно, о чём идёт речь. Ещё со школьной скамьи мы знаем, что гемоглобин – это белок, составная часть кровяных телец, отвечающий за доставку кислорода к тканям и всем органам человеческого организма. Если гемоглобина не хватает, от кислородного голодания страдают мозг и почки, а сердце вынуждено «гонять» большие объёмы крови, пытаясь обеспечить все органы кислородом.
Большинство из нас под понятием «низкий гемоглобин» подразумевают железодефицитную анемию. Чаще всего такой диагноз ставится женщинам, ведь ежемесячные «критические дни» и беременность отнимают драгоценный гемоглобин. Но причины понижения уровня гемоглобина в крови могут быть разными. Это могут быть заболевания, связанные с обильной кровопотерей, или некоторые заболевания желудочно-кишечного тракта, при которых железо не всасывается в кровь, или даже онкология.
Если содержание гемоглобина в крови несколько ниже нормы, не стоит мчаться в аптеку и покупать железосодержащие препараты, в этом случае с задачей повышения показателей отлично справятся продукты повышающие гемоглобин. Если же картина совсем удручающая, эти продукты будут отличным подспорьем в медикаментозном лечении. В любом случае нелишне будет знать о продуктах, повышающих гемоглобин, и о том, как их лучше всего есть, чтобы извлечь их них максимальную пользу.
Ещё одним важным фактом, говорящим в пользу продуктов, повышающих гемоглобин, является опасность передозировки железосодержащих препаратов и превышение уровня гемоглобина в крови, что чревато многими негативными последствиями: излишек гемоглобина откладывается в тканях и органах, увеличивает риск возникновения опухолей и инфекционных заболеваний, диабета, артрита, атеросклероза и печёночной недостаточности, «лишний» гемоглобин приводит к снижению аппетита, рвоте, изжоге, проблемам с кишечником, пигментации кожи, утомляемости и головокружению.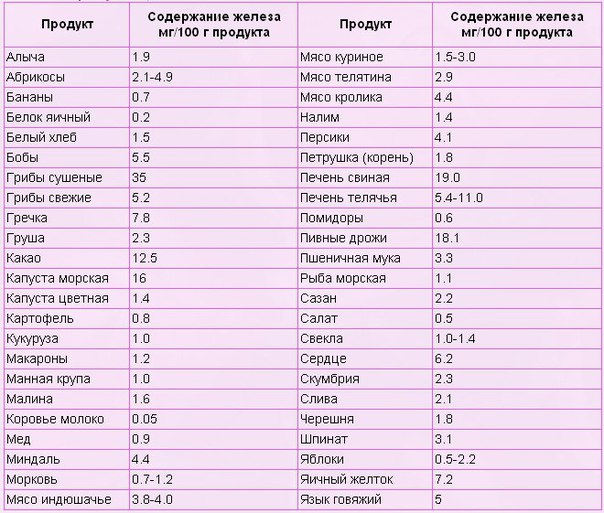
Ещё недавно считалось, что при анемии достаточно употреблять продукты, богатые железом, и проблема будет решена. Однако выяснилось, что одним из важных факторов является усваиваемость железа из продуктов. То есть, простая математика здесь не поможет. Вы можете поглощать морскую капусту и гречку килограммами, но железа усвоится при этом не так-то много. Наилучшими показателями в этом плане являются продукты животного происхождения. Предвосхищая возгласы протеста строгих вегетарианцев, спешу сказать, что при этом полностью отказываться от растительных продуктов не стоит, это принесёт только вред! В питании как нигде более важен баланс и ещё раз баланс. Просто для повышения гемоглобина нужно лишь немного увеличить количество определённых продуктов животного происхождения, а для тех, кто эти продукты вообще не ест, важно знать, в каких сочетаниях растительные продукты, содержащие большое количество железа, отдадут его наилучшим образом.
Железо содержится в продуктах в двух формах – гемо-железо (в продуктах животного происхождения) и негемо-железо (в растительных). Усваиваемость этих разных видов железа тоже разная. Гемо-железо усваивается намного лучше, чем железо из растительных продуктов. Так, например, гемо-железо из говядины усваивается на 17-20%, из печени и субпродуктов – на 10-20%, из рыбы – на 9-11%. Негемо-железо из растительных продуктов усваивается не так хорошо, всего от 1 до 7%. При этом, существуют продукты, как животные, так и растительные, в которых содержится довольно много железа (яйца, черника, шпинат и т.д.), но практически бесполезные для повышения гемоглобина, так как для усвоения железа из них нужны определённые условия.
Считается, что в среднем человеку необходимо около 1,5 мг железа в сутки. Эти показания меняются для разных групп населения. Женщинам нужно чуть больше железа, чем мужчинам (это и понятно), детям – поменьше, больше же всего железа необходимо мамочкам, ожидающим прибавления в семействе. Организмом усваивается примерно десятая часть всего железа, поступающего с пищей. Значит, железа вам нужно съесть в 10 раз больше. Именно поэтому так важно знать о продуктах, повышающих гемоглобин, и о содержании железа в них.
Организмом усваивается примерно десятая часть всего железа, поступающего с пищей. Значит, железа вам нужно съесть в 10 раз больше. Именно поэтому так важно знать о продуктах, повышающих гемоглобин, и о содержании железа в них.
На первом месте по содержанию железа и по степени его усваиваемости стоят продукты животного происхождения: красное мясо (преимущественно, говядина), печень, опять-таки говяжья, и другие субпродукты. Яичные желтки, икра, жирная морская рыба и морепродукты тоже являются хорошими поставщиками железа в организм.
Растительные продукты хотя и хуже отдают железо, но зато их перечень намного шире. К продуктам, повышающим гемоглобин, относятся гречка, свёкла, картофель, морковь, тыква, помидоры, яблоки, персики, абрикосы, гранат, арбуз, земляника, клубника, смородина, клюква… Список можно продолжить: это бобовые – соя, чечевица, фасоль, горох; крупы – ячменная крупа, толокно; а также семена подсолнуха, тыквы и кунжута, любые сухофрукты.
Гречневую крупу лучше не варить, а залить горячей водой в соотношении 1:2, укутать и оставить на ночь.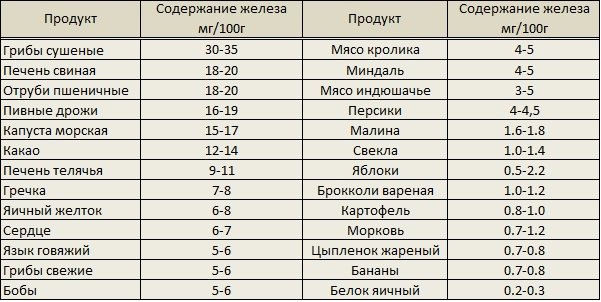 Попробуйте зелёную гречку (сейчас её можно купить в отделах здорового питания в супермаркетах), в ней намного больше полезных веществ, чем в обычной, прожаренной, и готовится она гораздо быстрее – достаточно замочить её на полчаса-час, и готово!
Попробуйте зелёную гречку (сейчас её можно купить в отделах здорового питания в супермаркетах), в ней намного больше полезных веществ, чем в обычной, прожаренной, и готовится она гораздо быстрее – достаточно замочить её на полчаса-час, и готово!
Свёклу тоже можно есть как в сыром виде, так и готовить её различными способами. Если вы решили поправить здоровье при помощи свёклы, имейте в виду, что есть её нужно в течение довольно-таки длительного времени каждый день, только в этом случае будет достигнут эффект. Блюд из варёной свёклы множество, а вот сырая не так популярна. Тем не менее, несмотря на предубеждения, можно есть этот корнеплод в сыром виде, и блюда из неё получаются не менее вкусными. Попробуйте добавлять сырую свёклу в салаты из капусты и моркови (тоже сырых). В летнюю жару приготовьте сырой холодный борщ – отличное освежающее и полное витаминов блюдо! В конце концов, выжмите из свёклы сок и смешайте его с апельсиновым – получится и вкусно, и полезно.
Растительные продукты лучше употреблять в сыром виде, насколько это возможно, или готовить их с минимальными потерями полезных веществ.
Но вернёмся к продуктам, повышающим гемоглобин. Одними из лучших поставщиков железа в организм являются орехи. Особенно полезны в этом смысле грецкие, которые желательно смешивать с мёдом – так получается не только вкуснее, но и полезнее. Грибы, особенно сушёные, не только содержат довольно большое количество железа, но и неплохо отдают его. Кроме этих продуктов, для повышения гемоглобина нужно употреблять мёд и патоку, пшеничные отруби, пивные дрожжи, морскую капусту, а также хорошее красное вино (лучше «Кагор») и чёрный шоколад.
Если вы обратили внимание, большинство продуктов, повышающих гемоглобин, имеют интенсивный, тёмный, чаше всего красный цвет. Очень удобно – не нужно держать в голове сводные таблицы продуктов с высоким содержанием железа, достаточно помнить об этой особенности, а также знать, что существуют продукты, способные улучшить или, напротив, значительно ухудшить усвоение железа организмом.
Так, например, продукты, содержащие танин, напрочь блокируют усвоение железа организмом, поэтому во время лечения или проведения лечебной диеты не стоит употреблять такие продукты, как чай и кофе. Тот же негативный эффект дают дубильные вещества – в айве и чернике их довольно много, причём черника содержит так же много и железа, но оно почти не усваивается. Ухудшают усвоение железа молочные продукты, сыр, а также яичные белки – в них содержатся фосфаты, препятствующие усвоению железа. Щавелевые кислоты, содержащиеся в щавеле и шпинате, также препятствуют этом процессу, а ведь в шпинате тоже довольно много железа! Кроме всего прочего, снижению усвоения железа способствуют дефицит витамина А и фолиевой кислоты, высокая концентрация кальция и цинка, а также низкая кислотность желудочного сока.
Зная эти особенности и исключив или значительно уменьшив количество вышеперечисленных продуктов, вы тем самым улучшите усвоение железа и поможете повысить уровень гемоглобина в крови.
Народная медицина знает множество рецептов для повышения уровня гемоглобина. Настои и отвары из крапивы, тысячелистника, корня одуванчика, кипрея, полыни, цветков клевера, шиповника – все эти рецепты доступны и просты. Например, на время лечения вместо привычного чая лучше готовить настой из плодов шиповника с лимонным соком и мёдом. Ещё одним вкусным лекарством может стать смесь размолотых грецких орехов, гречневой крупы (лучше зелёной), перемолотой в кофемолке, и мёда в равных частях.
Ещё один рецепт народной медицины для повышения гемоглобина состоит из сушёных листьев крапивы, мёда и цветочной пыльцы в соотношении 3:2:1. Принимайте снадобье по чайной ложке 3 раза в день, запивая водой. Есть и ещё один интересный рецепт, называющийся «5 стаканов»: выжмите по стакану морковного, свекольного и лимонного сока, добавьте стакан мёда и стакан хорошего коньяка. Оберните стеклянную банку фольгой и вылейте в неё полученную смесь. Принимайте по 1 ст.л. трижды в день до тех пор, пока не закончится содержимое банки. Для детей дозу уменьшите до 1 чайной ложки.
 Интересен и такой рецепт, противоречащий утверждению, что молоко препятствует усвоению железа: ½ стак. свежевыжатого морковного сока смешайте с ½ стак. горячего молока и выпейте натощак с утра, за 1,5-2 часа до еды.
Интересен и такой рецепт, противоречащий утверждению, что молоко препятствует усвоению железа: ½ стак. свежевыжатого морковного сока смешайте с ½ стак. горячего молока и выпейте натощак с утра, за 1,5-2 часа до еды.
Все эти рецепты и продукты повышающие гемоглобин, способствуют нормализации уровня гемоглобина в крови.
Питайтесь разнообразно и правильно и будьте здоровы!
Лариса Шуфтайкина
Продукты содержащие железо и повышающие гемоглобин
Замечали ли вы, что частенько испытываете вялость, быструю утомляемость, слабость, головокружение, одышку при физической нагрузке? Девушки, может быть, вы замечали сухость и ломкость волос при расчесывании, расслоение ногтей? Бледность и сероватый цвет кожи? Все это вместе или по отдельности может быть признаком дефицита железа в организме. Девушки, к вам это относится в первую очередь. Несложный анализ крови выявит этот дефицит, если он действительно есть.
Предположим, есть. По данным ВОЗ дефицит железа является основным и наиболее распространенным нарушением питания в мире. А вот как с ним справиться?
По данным ВОЗ дефицит железа является основным и наиболее распространенным нарушением питания в мире. А вот как с ним справиться?
Железо является важным микроэлементом, который играет решающую роль в производстве крови, транспортировке кислорода, а также в росте и развитии.
Суточная норма потребления железа составляет 18 мг для взрослых.
Мы получаем железо из нашей пищи. В продуктах животного происхождения железо присутствует в самой доступной форме — гемовое железо, как в гемоглобине – белке, который содержится в эритроцитах и переносит кислород. В растительных же продуктах железо негемовое. Доступность его для организма несколько меньше.
Исследования показывают, что у гемового железа биодоступность составляет 15-35% в зависимости от индивидуума, в то время как у негемового железа этот показатель падает до 2-20%.
Поэтому, чтобы быстро восполнить дефицит железа, придется есть животные продукты. Вот в таблице перечислены самые богатые железом продукты, с указанием количества и процента от суточной нормы.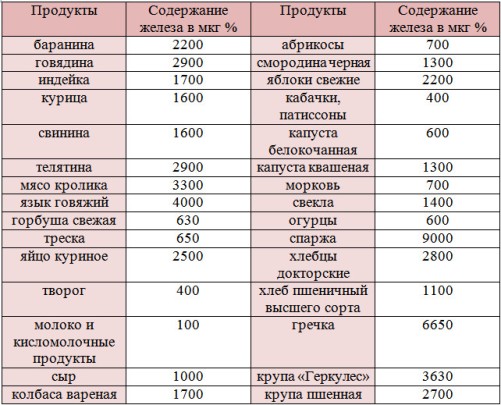 Информация взята из Национальной базы данных по составу пищевых продуктов Министерства сельского хозяйства США.
Информация взята из Национальной базы данных по составу пищевых продуктов Министерства сельского хозяйства США.
Продукты содержащие железо в большом количестве
| Продукт | Количество железа на 100 граммов продукта | % от суточной нормы |
| Утиная печень | 30,53 мг | 170% |
| Ливерная колбаса | 8,85 мг | 49% |
| Бараньи почки | 6,60 мг | 37% |
| Каракатица | 6,02 мг | 33% |
| Куриное сердце | 5,96 мг | 33% |
| Гусиная грудка | 5,91 мг | 33% |
| Стейк из постной говядины | 5,46 мг | 30% |
Как видите, самое большое содержание железа – в субпродуктах животных и птицы.
А если вы поститесь или убежденный вегетарианец?
Есть растительные продукты с высоким содержанием железа.
Как упоминалось ранее, растительная пища содержит негемовое железо, которое не так биодоступно, как гемовое, содержащееся в животных продуктах.
Тем не менее, некоторые растительные продукты содержат большое количество железа. Кроме того, потребление витамина С наряду с негемовым железом, по-видимому, улучшает усвоение этого минерала.
Вот десять растительных продуктов с высоким содержанием железа
| Продукт | Количество железа на 100 граммов продукта | % от суточной нормы |
| Какао порошок | 13,9 мг | 77% |
| Грибы сморчки | 12,18 мг | 68% |
| Натто, соевый продукт | 8,60 мг | 48% |
| Конопляное семя | 7,95 мг | 44% |
| Ягоды годжи | 6,80 мг | 38% |
| Орехи кешью | 6,68 мг | 37% |
| Льняное семя | 5,73 мг | 32% |
| Фундук | 4,70 мг | 26% |
| Арахис | 4,58 мг | 25% |
| Миндаль | 3,71 мг | 21% |
Как видите, железо можно получить из самых разнообразных продуктов.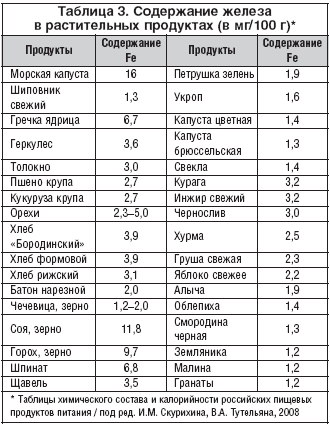 Растительная пища также может сыграть свою роль в удовлетворении потребностей в железе. Ешьте темный шоколад с большим содержанием какао, разнообразные семена и орехи, и с ними вместе фрукты , богатые витамином С, и вы будете поддерживать необходимый уровень железа, этого критически важного для качества жизни элемента. Делайте умный выбор и будьте здоровы и счастливы!
Растительная пища также может сыграть свою роль в удовлетворении потребностей в железе. Ешьте темный шоколад с большим содержанием какао, разнообразные семена и орехи, и с ними вместе фрукты , богатые витамином С, и вы будете поддерживать необходимый уровень железа, этого критически важного для качества жизни элемента. Делайте умный выбор и будьте здоровы и счастливы!
Низкий гемоглобин может быть признаком рака или язвы желудка — Российская газета
Для нормальной работы иммунной системы человека необходимо железо. Нехватка этого микроэлемента может привести к возникновению проблем с потенцией у мужчин и нарушить менструальный цикл у женщин. Низкий уровень гемоглобина может предупреждать и о других серьезных заболеваниях.
Признаки нехватки железа в организме могут проявляться в упадке сил, депрессии, выпадении волос и сухости кожи, сонливости и раздражительности. Однако чтобы определить настоящую анемию и восполнить дефицит железа, необходимо провести развернутый анализ крови.
«Если у мужчины гемоглобин снижен хотя бы немного, допустим, до 120-110 г/л крови, то это уже красный флаг. Даже если он не испытывает при этом усталости и у него нет других симптомов анемии», — заявила изданию aif.ru руководитель Центра формирования здорового образа жизни Ирина Добрецова. Для мужчины норма гемоглобина — 130-160 г/л крови, для женщины — 120-140 г/л. Пониженный гемоглобин может говорить о наличии полипа, язвы желудка, эрозии и даже о начинающемся раке кишечника или желудка.
В зоне риска находятся вегетарианцы и любители жестких диет, подростки во время гормональной перестройки организма, дети-спортсмены, не принимающие дополнительно витаминно-минеральные комплексы. Если беременные женщины не принимают специальные поливитамины, то они также рискуют заболеть анемией.
Врач напоминает, что препараты для восполнения запасов гемоглобина и ферритина не стоит покупать самостоятельно в аптеке. Их назначают только медики. Кроме того, действие лекарств начинается лишь с шести месяцев и потому нельзя прерывать курс лечения.
Кстати
Важно помнить, что препараты, содержащие железо, нельзя совмещать с молочными продуктами. Нежелательно также запивать железосодержащие препараты черным чаем. Зато прекрасный результат даст апельсиновый сок, который помогает всасыванию железа. Помогут восстановить микроэлементы нежирное красное мясо (говядина и баранина), печень, гранат, морская капуста и тыквенные семечки.
Продукты, повышающие гемоглобин в крови
Гемоглобин – элемент, который отвечает за транспортировку кислорода к тканям и органам. В этом заключена его главная функция.
Нормальное содержание гемоглобина в крови у женщин — от 120 до 150 г/л; у мужчин – от 130 до 170 г/л, а у детей от 110 до 130 г/л.
Нехватка гемоглобина в крови может спровоцировать возникновение малокровия, общей слабости и снизить иммунитет.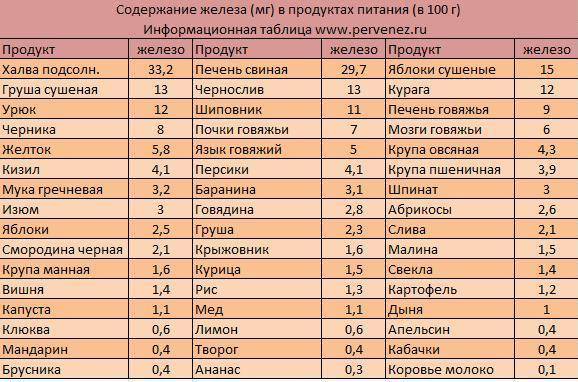
Повысить уровень гемоглобина в крови можно с помощью продуктов, содержащих в своём составе железо.
Кому нужны продукты, повышающие гемоглобин?
Продукты, повышающие гемоглобин, необходимы беременным для развития будущего малыша, людям, которые перенесли тяжёлую болезнь, во время обострения весеннего авитаминоза.
Продукты, повышающие гемоглобин будут актуальны для спортсменов и всех, кто интенсивно занимается спортом.
В период перед началом эпидемий простудных заболеваний продукты, повышающие гемоглобин, помогут заранее укрепить иммунитет и защитить организм от гриппа.
Топ-10 продуктов, повышающих гемоглобин в крови
1 место в этом списке занимает печень, мясо, сливочное масло, молоко, если пить его маленькими глотками, и сливки.
2 место делят между собой гранат, малина, земляника, чеснок, виноград, пшеничная крупа и бананы.
3 в этом списке свекла, только её нужно есть 4 месяца по 30 г свежей или по 150 г варёной в день.
4 место занимают сезонные продукты — дыня и арбузы.
На 5 месте по количеству гемоглобина находятся яблоки. Есть их нужно по 500 г каждый день.
Для лечения малокровия будет очень полезна рябина, находящаяся
на 6 месте в топ-10, также благодаря содержанию витамина С. Рябиновый сок лучше пить 4 раза в день по 1 ст. л.
7 место занимает отвар шиповника. Чтобы приготовить отвар, 2 ст. л. ягод нужно залить стаканом кипятка. Пить его следует по стакану в день.
Салат из моркови со сметаной и морковный сок занимают 8 место в этом списке. В день лучше пить по 150 мл сока до еды 3 раза.
9 место занимает молодая крапива. Обдав кипятком, добавляйте её в салаты. Для лечения малокровия 1 ст. л. сухой крапивы следует залить 1 стаканом кипятка и оставить настаиваться на 30 мин. Пить по 1 ст. л. 4 раза в день.
10 место по источнику гемоглобина занимают грецкие орехи. В день нужно съедать по 100 г орехов с мёдом в 4 приёма.
В день нужно съедать по 100 г орехов с мёдом в 4 приёма.
Группы продуктов, повышающих гемоглобин
Продукты, повышающие гемоглобин, принято делить на несколько групп. Это помогает легче запомнить, какие продукты необходимы в случае нехватки гемоглобина, и для профилактики заболеваний, вызванных его недостатком.
К первой группе относятся злаки, бобовые и зерновые. Это перловая, гречневая каша, овсянка, фасоль и горох.
Ко второй группе принято относить зелень.
В третью группу попадают проростки. Наиболее богатыми на гемоглобин будут проростки чечевицы и пшеницы.
К четвёртой группе относятся все свежевыжатые соки. Это яблочный, морковный сок, сок из ромашки и крапивы.
5 группа – это сухофрукты, которые в своём составе содержат питательные вещества и минералы в концентрированном виде. Употребление 100 г сухофруктов в день быстро увеличит количество гемоглобина в крови.
6 группа – это овощи: помидоры, болгарский перец, морковь, редис, редька, тыква, свекла.
К 7 группе относятся ягоды и фрукты. Это малина, клубника, черника, клюква, земляника, шиповник, черешня и вишня и цитрусовые.
Как повышается гемоглобин в крови?
Существуют медицинские препараты, которые помогают восполнить нехватку гемоглобина в крови и повысить его уровень до нормального. Но всё-таки они остаются химическими препаратами, к помощи которых следует обращаться в самых сложных случаях и после назначения врача. Поэтому лучше всего для повышения уровня гемоглобина в крови употреблять продукты, содержащие железо.
Сам гемоглобин повышается в крови постепенно. По времени это занимает около 3 недель. Поэтому вводите в свой рацион эти продукты заранее, а ещё лучше старайтесь их кушать всё время. Это поможет предотвратить нехватку гемоглобина и укрепит иммунитет. Не следует ограничиваться только продуктами, повышающими гемоглобин, в свой рацион также включайте и другие продукты, насыщенные минералами и витаминами. Они будут прекрасно дополнять друг друга.
Они будут прекрасно дополнять друг друга.
Чтобы быстро повысить уровень гемоглобина в крови, старайтесь соблюдать соотношение 80% к 20%. 80% продуктов, содержащих фолиевую кислоту и железо, а 20% продуктов, содержащих остальные минералы и витамины.
Продукты, повышающие гемоглобин при беременности Во время беременности уровень гемоглобина должен быть всегда в норме. Поэтому в рацион беременных необходимо обязательно включать мёд. 50 г настоящего мёда каждый день поможет повысить гемоглобин и насытить организм ценными микроэлементами. Необходимо обязательно исключить сигареты и алкоголь. Они напрямую влияют на уменьшение гемоглобина в крови. В рацион следует включить пророщенные ростки злаков, которые будут особенно ценны для здоровья беременной мамы и будущего малыша.
Гемоглобин является важнейшим элементом, который обеспечивает все наши ткани и органы кислородом и отвечает за нормальную работу организма. Его нехватка является причиной возникновения малокровия и может вызвать возникновение различных заболеваний.
Продукты питания, содержащие много железа, повышающие гемоглобин
Железодефицитная анемия сейчас очень распространенное заболевание. По данным медиков, около 20% населения земного шара сейчас в той или иной степени страдают от недостатка железа в крови.
Повысить гемоглобин без соблюдения грамотно составленного рациона питания достаточно сложно. Регулярно употребляя продукты, богатые железом: крупы (пшеница, овес, гречка, пшено), абрикосы, морскую капусту, сухофрукты, субпродукты (почки, селезенку), яйца, какао, ягоды, цельнозерновой хлеб, настой шиповника, гранатовый сок, орехи, мед (особенно гречишный) бобовые, брокколи, зеленый чай, ананасы, арахисовое масло, можно значительно улучшить состав крови и общее самочувствие.
Но и среди этих продуктов есть настоящие рекордсмены по содержанию железа, необходимого для поднятия гемоглобина.
Халва
На первом месте стоит халва тахинная (кунжутная) – 50,1 мг железа на 100 гр продукта. А на втором – более привычная для нас подсолнечная халва (33,2 мг). Так что это восточное лакомство, благодаря своему минеральному составу, приносит огромную пользу организму.
А на втором – более привычная для нас подсолнечная халва (33,2 мг). Так что это восточное лакомство, благодаря своему минеральному составу, приносит огромную пользу организму.
Помимо того, что употребление халвы улучшает состав крови, очищает ее и повышает уровень гемоглобина, в ней присутствуют «сердечные» минералы – магний, марганец, медь, калий, цинк, что делает этот десерт незаменимым продуктом для сердечно-сосудистой системы в целом. Кальций, входящий в состав халвы, улучшает состояние костной системы, ногтей и зубов, предотвращает возникновение остеопороза.
И кунжутная, и подсолнечная халва содержат большое количество витаминов для красоты и молодости (С, F, E), а фосфор и витамины группы В помогают справляться с перегрузками нервной системе и улучшают когнитивные функции мозга. Если вы будете понемногу добавлять к своему рациону халву, то улучшите работу бронхов и легких, проведете серьезную профилактику онкологических заболеваний и даже избавитесь от мигреней.
Свиная печень
Содержит 29 мг железа на 100 гр веса. Этот продукт стоит на третьем месте по содержанию железа и активно рекомендуется медиками всем, кто имеет проблемы с составом крови. Она уместна в питании больных малокровием, атеросклерозом и сахарным диабетом. В свиной печени присутствуют практически все незаменимые аминокислоты, ферменты, витамины группы В, ретинол, E, D, K, Н и минеральные вещества – медь, магний, натрий, фосфор, калий, кальций и пр.
Этот продукт стоит на третьем месте по содержанию железа и активно рекомендуется медиками всем, кто имеет проблемы с составом крови. Она уместна в питании больных малокровием, атеросклерозом и сахарным диабетом. В свиной печени присутствуют практически все незаменимые аминокислоты, ферменты, витамины группы В, ретинол, E, D, K, Н и минеральные вещества – медь, магний, натрий, фосфор, калий, кальций и пр.
Благодаря своему сбалансированному составу печень не только поставляет железо в организм, но и помогает ему усваиваться. Блюда из печени рекомендуются во время беременности и кормления, детям и пожилым людям, при общем переутомлении, лучевой болезни и при снижении работоспособности органов кроветворения.
Сушеные яблоки
Содержат 15 мг железа на 100 гр веса. Этот продукт необходим для лимфатической системы, великолепно очищает кровь, поэтому полезен при низком давлении и атеросклерозе сосудов. Кроме того, яблоки содержат биологически доступные вещества, которые способствуют более качественному усвоению железа из остальных продуктов, например из печени, почек или яиц. Сушеные яблоки принято добавлять в рацион больных, страдающих атеросклерозом, подагрой, ревматизмом, хронической экземой, псориазом и другими болезнями кожи.
Сушеные яблоки принято добавлять в рацион больных, страдающих атеросклерозом, подагрой, ревматизмом, хронической экземой, псориазом и другими болезнями кожи.
В сушеных яблоках присутствует до 12% различных сахаров – глюкоза фруктоза, сахароза; пектины, дубильные вещества, антиоксиданты, органические кислоты, фосфор, железо, калий, клетчатка, эфирные масла, бета-каротин, аскорбиновая кислота, витамины группы В, флавоноиды. Присутствие пектиновых веществ обуславливает низкий гликемический индекс этих сухофруктов, что важно для диабетиков.
Чернослив
Количество железа такое же, как и в сушеных яблоках. Этот вид сухофруктов обладает великолепным вкусом и применяется как самостоятельный десерт, а также как добавка ко многим горячим блюдам (рагу, плов, тушеное мясо) и салатам. В сушеных сливах много натрия, калия, фосфора, кальция; он богат сахарами, клетчаткой, органическими кислотами.
Чернослив уместен в лечебно-профилактическом питании при сердечно-сосудистых патологиях (на ранних стадиях), для нормализации артериального давления, при ожирении и других нарушениях обменных процессов в организме.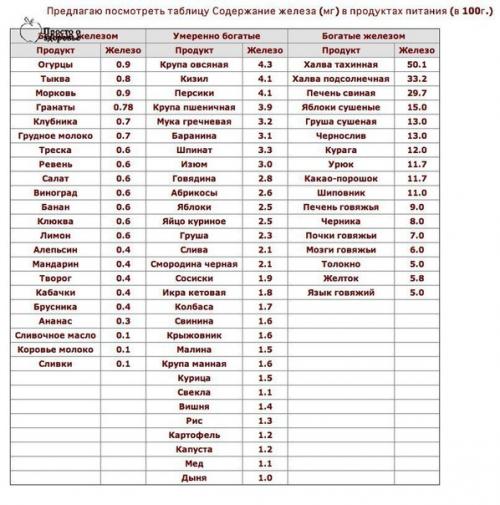 Регулярное употребление чернослива нормализует работу кишечника, усиливая его перистальтику, способствует снижению веса. Сушеные сливы имеют также противоопухолевые, бактерицидные, общеукрепляющие и тонизирующие свойства, снижают утомляемость, повышают бодрость и настроение.
Регулярное употребление чернослива нормализует работу кишечника, усиливая его перистальтику, способствует снижению веса. Сушеные сливы имеют также противоопухолевые, бактерицидные, общеукрепляющие и тонизирующие свойства, снижают утомляемость, повышают бодрость и настроение.
Повысить гемоглобин в крови можно, употребляя вкусные и полезные продукты. При грамотном сочетании продуктов усвояемость железа повышается в разы.
ТОП 14 препаратов железа — рейтинг хороших средств 2021
Препараты железа назначаются для лечения железодефицитной анемии, которая диагностируется преимущественно у детей и женщин. Среди основных причин развития данного состояния следует выделить нерациональное питание и кровотечения. При дефиците железа в организме развивается анемия, которая характеризуется понижением гемоглобина.Типичные признаки – бледность кожи, головокружения, быстрая утомляемость, раздражительность и вялость.
Железо, поступающее с пищей, усваивается не полностью.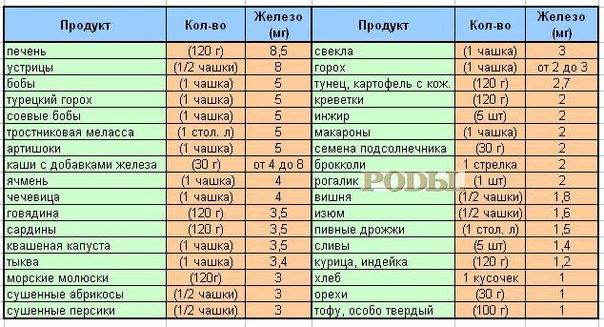 Недостаток жизненно необходимого микроэлемента приводит к снижению уровня ферритина и гемоглобина в крови, что чревато затруднением тканевого дыхания. Восполнять дефицит рекомендуется с помощью специальных медикаментов. Лучшие препараты железа представлены в ТОПе. Ниже описаны эффективные лекарства для взрослых, детей и беременных женщин.
Недостаток жизненно необходимого микроэлемента приводит к снижению уровня ферритина и гемоглобина в крови, что чревато затруднением тканевого дыхания. Восполнять дефицит рекомендуется с помощью специальных медикаментов. Лучшие препараты железа представлены в ТОПе. Ниже описаны эффективные лекарства для взрослых, детей и беременных женщин.
Классификация антианемических средств
Добавки существуют в 2-х основных видах:
- Двухвалентная форма (сульфаты). Концентрация микроэлемента в составе больше. Но они вызывают много побочных реакций.
- Трехвалентная форма (плюс аминокислоты). Аминокислота помогает микроэлементу лучше усваиваться. Легкодоступная хелатная форма сводит вероятность возникновения побочных реакций к минимуму.
Нормальный уровень гемоглобина в крови взрослого человека составляет от 120 до 150 г/л. Если организм самостоятельно не может поддерживать этот показатель, то возникает необходимость в проведении лекарственной терапии.

Группы препаратов, повышающих гемоглобин:
- Монопрепараты. Разработаны на основе Fe3+. В составе не содержится дополнительных активных компонентов.
- Витаминные комплексы. Содержат различные минералы и микроэлементы, в основном витамины группы В и аминокислоты.
Лекарства можно принимать только после консультации с врачом. Специалист поможет подобрать эффективное лекарство и грамотно рассчитает дозировку.
Причины развития железодефицитной анемии
Организм нуждается в Fe3+ для производства гемоглобина, белка, ответственного за транспортировку кислорода в ткани. Анемия возникает, когда уровень гемоглобина в эритроцитах снижается. Следовательно, когда в кровотоке недостаточно микроэлемента, органы и ткани не получают необходимый им кислород.
Существует несколько причин, которые приводят к дефициту этого минерала:
- Менструация или роды. Тяжелое менструальное кровотечение и кровопотеря во время родов обычно приводят к осложнениям.

- Внутреннее кровотечение. Прием болеутоляющих средств часто приводит к кровотечению в желудке. Кроме того, некоторые патологии могут вызвать внутреннее кровотечение, например, язвы в желудке, полипы в кишечнике и рак толстой кишки.
- Мальабсорбция микроэлемента. Некоторые кишечные расстройства, такие как целиакия и болезнь Крона, мешают поглощению веществ. С другой стороны, операция на кишечнике, такая как желудочный шунт, также может влиять на количество микроэлемента, которое способен поглощать организм.
Есть люди, которые подвергаются наибольшему риску. Например, вегетарианцы, которые исключают из рациона мясо. Также предрасположенность имеется у тех, кто часто сдает кровь и у детей, родившихся семимесячными.
Тем, кто входит в группу риска и испытывает симптомы дефицита нужно обратиться к врачу. Специалист направит на анализ крови, и, возможно, предложит некоторые изменения в питании и при необходимости назначит лечение.
Рейтинг препаратов железа
Какой препарат железа при анемии выбрать подскажет ТОП-15. Мы собрали наиболее эффективные лекарственные средства, которые практически не вызывают побочных реакций. Рейтинг медикаментов основан на анализе характеристик всех медикаментов и отзывах покупателей.
ТОП лучших препаратов железа при низком гемоглобине
№1 – «Фенюльс» (капсулы)
Самый лучший препарат железа при анемии, представленный комплексом витаминов и микроэлементов. Особенность заключается в микродиализных гранулах, которые постепенно выделяют составные части.
Капсулы «Фенюльс» назначаются при:
- хронических кровопотерях;
- алиментарной недостаточности;
- повышенной потребности.
Входящие в состав витамины группы В и аскорбиновая кислота улучшают всасывание активного компонента, предупреждая перенасыщение организма.
№2 – «Феррум Лек» (жевательные таблетки)
Лучший препарат для поднятия железа, который относится к группе трехвалентных. Отличается стабильностью, не выделяя свободных ионов. По структуре активный компонент имеет схожесть с естественным соединением Fe3+, поэтому хорошо усваивается.
Отличается стабильностью, не выделяя свободных ионов. По структуре активный компонент имеет схожесть с естественным соединением Fe3+, поэтому хорошо усваивается.
Ионы активно всасываются в области кишечника, что исключает вероятность интоксикации, вызванной передозировкой. «Феррум Лек» назначается младенцам и детям младшего возраста, а также могут быть использованы в период беременности.
№3 – «Феррум Лек» (раствор)
Эффективное средство для лечения анемии, которое предназначено для лиц, страдающих нарушениями со стороны желудочно-кишечного тракта. Отличается стабильным макромолекулярным комплексом.
Раствор «Феррум Лек» — лучший препарат железа для беременных женщин. Благодаря тому, что Fe3+поступают в кровь из кишечника, активно всасываясь, передозировка исключена. Дефицитные состояния быстро устраняются. Раствор также может быть использован для пациентов детского возраста.
№4 – «Сорбифер Дурулес» (таблетки)
Хорошее железо в таблетках, которое поэтапно высвобождается на протяжении длительного периода, постепенно насыщая организм. Используется в качестве профилактики в период беременности, при лактации и у людей, которые являются донорами крови.
Используется в качестве профилактики в период беременности, при лактации и у людей, которые являются донорами крови.
№5 – «Тотема» (раствор для приема внутрь)
Комбинированный препарат незаменим для беременных женщин. В состав входят:
- Железо. Синтезируем гемм, входящий в состав гемоглобина и принимающий участие в окислительно-восстановительных реакциях.
- Марганец и медь. Кофакторы (соединения, участвующие в биологической деятельности) ферментов.
Постепенно регрессирует лабораторные и клинические симптомы анемии. Всасывание активных веществ осуществляется в верхнем отделе тощей кишки и в двенадцатиперстной кишке.
№6 – «Мальтофер» (капли)
Антианемическое средство имеет доказанную клиническую эффективность. Широко используется для новорожденных и недоношенных детей. Всасываемое вещество Fe3+ используется организмом для синтеза гемоглобина в области костного мозга или хранится в печени (где связывается с ферритином).
№7 – «Мальтофер Фол» (жевательные таблетки)
Содержит такие действующие вещества, как гидроксид железа с полимальтозой и фолиевую кислоту. Подходит для взрослых и детей с 12 лет. Недостаток заключается в наличии вероятности передозировки.
При несоблюдении рекомендаций производителя или при индивидуальной предрасположенности организма возможно развитие побочных реакций в виде головной боли, кожного зуда, мышечных спазмов. Жевательные таблетки могут спровоцировать окрашивание кала в темный цвет, что не является отклонением.
№8 – «Мальтофер» (таблетки жевательные)
Назначается для лечения латентного дефицита (без анемии). Таблетированная форма удобна для расчета дозировки. Исключает вероятность причинения вреда организму, вызванного передозировкой.
Незаменимый вариант для беременных и кормящих женщин. Это обусловлено отсутствием нежелательных последствий для плода или грудного ребенка. Не рекомендуется принимать детям до 12 лет. Жевательные таблетки «Мальтофер» — лучшее лекарство при проблемах с поджелудочной железой.
Жевательные таблетки «Мальтофер» — лучшее лекарство при проблемах с поджелудочной железой.
№9 – «Мальтофер» (сироп)
Препарат железа при анемии, который лучше усваивается. Форма выпуска в виде сиропа удобна тем, что имеется возможность в более точном дозировании. Таблетки нужно дробить или раскалывать, чтоб добиться нужной дозы активного компонента. Сироп позволяет упростить процесс. Выпускается в виде сиропа быстрее усваивается.
Единственный недостаток – более высокая цена, чем другие формы выпуска.
№10 – «Ферлатум» (раствор)
Имеет уникальную формулу. Содержит Fe3+ — соединение атомов с полусинтетическим белковым носителем, который предотвращает повреждение слизистой желудка. Возможность передозировки исключена благодаря тому, что активный компонент поступает в кровь путем всасывания (транспорта).
№11 – «Ферлатум Фол» — порошок для приготовления раствора
Разработано на основе кальция фолината пентагидрата и Fe3+.
«Ферлатум Фол» назначается:
- при латентном и клинически выраженном дефиците;
- для профилактики в период беременности, лактации, при длительных кровотечениях, в период активного роста и при несбалансированном или неполноценном питании.
При приготовлении раствора рекомендуется соблюдать рекомендации, указанные производителем. Случаев передозировки выявлено не было.
№12 – «Ферретаб» (капсулы)
Если не знаете, какой препарат железа лучше купить, обратите внимание на капсулы пролонгированного действия «Ферретаб». Комбинированное средство воздействует на организм комплексно:
- Железа фумарат. Принимает участие в синтезе гемоглобина. Представлен в виде солей, которые быстро восполняют дефицит микроэлементов в организме, постепенно устраняя повышенную утомляемость, слабость, тахикардию и головокружение. Также исчезает сухость и бледность кожи.
-
Фолиевая кислота. Способствует нормальному созреванию мегалобластов и образованию нормобластов.
 Принимает участие в синтезе аминокислот. Предупреждает развитие анемии, выкидыши и преждевременные роды. Исключает нарушение умственного развития у детей.
Принимает участие в синтезе аминокислот. Предупреждает развитие анемии, выкидыши и преждевременные роды. Исключает нарушение умственного развития у детей.
№13 – «Фероглобин В12» (капсулы)
Занимает не последние места в рейтинг препаратов железа. Способствует формированию эритроцитов и синтезу аминокислот. Медь и аскорбиновая кислота повышают эффективность всасывания основного действующего вещества. Марганец регулирует углеводные обменные процессы в организме.
Капсулы «Фероглобин В12» нормализуют биосинтез гемоглобина и активируют окислительно-восстановительные процессы, устраняя симптомы, которые сопутствуют анемии (вялость и слабость, недостаточную умственную и физическую активность).
№14 – «Актиферрин» (капли для приема внутрь)
Антианемическое средство содержит Fe3+ и D,L-серин. Способствует быстрому восстановлению нормального баланса. Уникальная фармакологическая разработка обеспечивает лучшую переносимость действующих веществ, позволяя снизить нужную дозу.
Высокие дозировки могут стать причиной развития жизнеугрожающих состояний. Именно поэтому дозировку должен рассчитывать специалист. Неконтролируемый прием недопустим. Применение при беременности и лактации возможно только в том случае, если потенциальная польза для матери превышает возможный вред для ребенка.
Выводы
Лучшие таблетки для поднятия уровня железа самостоятельно подобрать сложно. Важно учитывать индивидуальные особенности организма, сопутствующие заболевания и лабораторные показатели. Окончательное решение должен принимать врач. Перед покупкой обязательно проконсультируйтесь со специалистом.
Большинство покупателей отдает предпочтение таким фирмам производителям, как Lek d. d. (Словения), Vifor (Швейцария), Ranbaxy (Индия) и др. Вопрос, какие препараты железа лучше принимать, задавайте своему лечащему врачу. Рейтинг представлен исключительно в ознакомительных целях и не должен быть использован в качестве терапевтической рекомендации.
Список литературы:
https://health.mail.ru/disease/anemiya/
https://www.eurolab.ua/medicine/atc/list/82/
https://www.vidal.ru/drugs/atc/b03ab
Эритроциты
Эритроциты (красные кровяные клетки) – самые многочисленные клетки крови, содержащие гемоглобин. Их основная функция – доставлять кислород к тканям и органам.
Определение количества эритроцитов является неотъемлемой частью общего анализа крови и отдельно не производится.
Синонимы русские
Число эритроцитов, количество эритроцитов, подсчет количества эритроцитов.
Синонимы английские
Red blood cell count, RBC count, RCC, red cell count, erythrocyte count, red count.
Единицы измерения
*1012/л (10 в ст. 12 на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Общая информация об исследовании
В ходе этого теста подсчитывается количество эритроцитов в определенном объеме крови – в литре или в микролитре.
Эритроциты, которые образуются в костном мозге, доставляют кислород к органам и тканям, а также способствуют переносу углекислого газа от органов и тканям к легким, где он выдыхается. Это происходит за счет того, что они содержат белок гемоглобин, который легко вступает в связь с кислородом и углекислым газом.
Изменение количества эритроцитов, как правило, сопряжено с изменениями уровня гемоглобина. Когда количество эритроцитов и уровень гемоглобина снижены – у пациента анемия, когда повышена – полицитемия.
В норме продолжительность жизни эритроцита – около 120 дней. Организм старается поддерживать примерно одинаковое число циркулирующих эритроцитов. При этом старые эритроциты уничтожаются в селезенке, а новые образуются в костном мозге.
Если баланс между образованием и разрушением эритроцитов нарушается из-за потери эритроцитов, их разрушения или уменьшения их образования, то развивается анемия. Наиболее частые причины потери эритроцитов – это острое или хроническое кровотечение либо гемолиз (разрушение в кровяном русле). Организм возмещает такие потери, увеличивая производство эритроцитов в костном мозге. Этот процесс регулирует гормон эритропоэтин, образующийся в почках.
Организм возмещает такие потери, увеличивая производство эритроцитов в костном мозге. Этот процесс регулирует гормон эритропоэтин, образующийся в почках.
Снижаться продукция эритроцитов может, когда нарушается нормальная работа костного мозга. Причиной подобного нарушения может быть инфильтрация мозга опухолевыми клетками или угнетение его функции под воздействием радиации, химиотерапии, из-за нехватки эритропоэтина (образующегося в почках вещества, которое стимулирует образование эритроцитов) или из-за недостатка веществ, необходимых для образования гемоглобина (железа, витамина B12, фолиевой кислоты).
Снижение производства эритроцитов приводит к уменьшению их циркуляции в кровяном русле, недостатку гемоглобина и его способности переносить кислород, а следовательно, к слабости и утомляемости.
В свою очередь, число эритроцитов увеличивается при более активной работе костного мозга. К этому могут приводить разные причины, например чрезмерный уровень эритропоэтина, повышающее число эритроцитов хроническое расстройство (истинная полицитемия) или курение.
Для чего используется исследование?
- Тест на эритроциты, вместе с гемоглобином и гематокритом, применяют, чтобы выявить любые варианты анемии или полицитемии.
- Эти показатели обычно входят в так называемый клинический (общий) анализ крови. Кроме того, он включает в себя определение различных характеристик эритроцитов (формы, размеров, объема), которые, как правило, позволяют уточнить вариант анемии.
Когда назначается исследование?
Обычно исследование входит в рутинный общий анализ крови, который делается как планово, так и при различных болезнях и патологических состояниях, перед хирургическими вмешательствами.
Повторно его обычно назначают пациентам, страдающим от кровотечений или хронической анемии.
Что означают результаты?
Референсные значения
|
Возраст |
Пол |
Эритроциты, *10^12/л |
|
|
3,9-5,9 |
|
|
14 дней – 1 мес. |
|
3,3-5,3 |
|
1-4 мес. |
|
3,5-5,1 |
|
4-6 мес. |
|
3,9-5,5 |
|
6-9 мес. |
|
4-5,3 |
|
9-12 мес. |
|
4,1-5,3 |
|
1-3 года |
|
3,8-4,8 |
|
3-6 лет |
|
3,7-4,9 |
|
6-9 лет |
|
3,8-4,9 |
|
9-12 лет |
|
3,9-5,1 |
|
12-15 лет |
мужской |
4,1-5,2 |
|
женский |
3,8-5 |
|
|
15-18 лет |
мужской |
4,2-5,6 |
|
женский |
3,9-5,1 |
|
|
18-45 лет |
мужской |
4,3-5,7 |
|
женский |
3,8-5,1 |
|
|
45-65 лет |
мужской |
4,2-5,6 |
|
женский |
3,8-5,3 |
|
|
> 65 лет |
мужской |
3,8-5,8 |
|
женский |
3,8-5,2 |
Снижение уровня эритроцитов обычно свидетельствует о хроническом или остром кровотечении, что приводит к развитию анемии. Кроме того, ее причиной может быть разрушение эритроцитов внутри организма или нехватка железа либо витамина B12, которые необходимы для образования гемоглобина.
Кроме того, ее причиной может быть разрушение эритроцитов внутри организма или нехватка железа либо витамина B12, которые необходимы для образования гемоглобина.
Причины повышения уровня эритроцитов:
- дегидратация (обезвоживание) из-за сгущения крови – гемоконцентрации;
- истинная полицитемия в результате избыточной продукции эритроцитов в костном мозге;
- хроническая обструктивная болезнь легких;
- хроническая сердечная недостаточность;
- талассемия – генетическое заболевание, приводящее к нарушению синтеза гемоглобина; при этом уровень гемоглобина будет снижен, а количество эритроцитов повышено;
- гипоксия (кислородное голодание) тканей любого происхождения, например вследствие курения.
Причины понижения количества эритроцитов:
- железо-, B12— или фолиево-дефицитная анемия;
- острое или хроническое кровотечение;
- хронические болезни почек — в этом случае происходит снижение синтеза гормона эритропоэтина, который стимулирует образование эритроцитов в костном мозге;
- цирроз печени;
- микседема – снижение функции щитовидной железы;
- онкологические заболевания костного мозга или метастазы других опухолей в костный мозг;
- апластическая анемия;
- системные заболевания соединительной ткани;
- хронические инфекции.

Что может влиять на результат?
Факторы, повышающие количество эритроцитов:
- у лиц, поднимающихся на большую высоту, наблюдается увеличение количества эритроцитов, так как их организм адаптируется к пониженной концентрации кислорода;
- уровень эритроцитов может быть повышен у курильщиков вследствие кислородного голодания тканей;
- длительное наложение жгута во время взятия крови способно приводить к ложнозавышенным результатам.
Факторы, понижающие количество эритроцитов:
- беременность;
- вегетарианская диета;
- гентамицин и пентоксифиллин.
Также рекомендуется
Кто назначает исследование?
Врач общей практики, терапевт, гематолог, нефролог, хирург.
Сравнение характеристик переносчиков кислорода на основе гемоглобина FDA может помочь в разработке безопасных и эффективных продуктов искусственной крови
Ученые Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) составили первое всестороннее молекулярное и химическое сравнение всех переносчиков кислорода (HBOC) на основе гемоглобина (HBO), которые были протестированы на людях.
Ученые FDA провели идентичные биохимические исследования этих HBOC, все из которых потерпели неудачу в клинических исследованиях из-за их токсичности, чтобы создать индивидуальные профили их биохимических действий; например, их способность связывать и выделять кислород в различных условиях и их индивидуальные взаимодействия с клетками.
Результаты исследования важны, поскольку они могут помочь объяснить индивидуальные характеристики безопасности и эффективности каждого типа HBOC.В свою очередь, это позволит ученым выбирать между различными биохимическими характеристиками для разработки безопасных и эффективных продуктов.
HBOC представляют собой тип искусственного кровезаменителя, изготовленного из молекул гемоглобина (Hb) — белка, переносящего кислород в красных кровяных тельцах, — которые либо удаляются из клеток и химически модифицируются во время переработки в продукт, либо разрабатываются с помощью генной инженерии. Они были изучены в качестве лечения пациентов, которые перенесли серьезную потерю крови из-за травм. Однако, поскольку молекулы Hb, составляющие эти продукты, не находятся внутри клеток, а скорее циркулируют в организме в виде свободных молекул, они могут накапливаться до токсических уровней.
Однако, поскольку молекулы Hb, составляющие эти продукты, не находятся внутри клеток, а скорее циркулируют в организме в виде свободных молекул, они могут накапливаться до токсических уровней.
Ключом к токсичности HBOC является то, что, в отличие от гемоглобина внутри эритроцитов, эти свободные молекулы подвергаются разрушительной химической реакции, которую нельзя обратить вспять. Эта реакция, называемая окислением, происходит после того, как HBOC высвобождают свои молекулы кислорода и оставляет белок неспособным связываться с дополнительными молекулами кислорода. Кроме того, реакция делает HBOC очень химически реактивным, вызывая потенциально опасное для жизни высокое кровяное давление, сердечный приступ и инсульт.Эти осложнения помешали полной разработке продуктов HBOC, несмотря на попытки модифицировать различные продукты Hb для устранения их токсического действия.
Кроме того, продукты HBOC обычно представляют собой сложные комбинации молекул гемоглобина, которые имеют множество возможных химических модификаций, что затрудняет прогнозирование того, насколько хорошо они будут работать в качестве переносчиков кислорода и какой тип токсичности они могут иметь. На сегодняшний день FDA не одобрило никаких HBOC для использования у людей.
На сегодняшний день FDA не одобрило никаких HBOC для использования у людей.
Сравнение различных типов HBOC, проведенное FDA, позволяет ученым лучше понять, как структура и химическая активность этих белков связаны как с их способностью переносить кислород в организме, так и с их потенциальной токсичностью для человека.
НАЗВАНИЕ
Всесторонняя биохимическая и биофизическая характеристика гемоглобиновых переносчиков кислорода Терапевтические средства: не все HBOC созданы одинаково.
Биоконъюг Хим. 2 апреля 2018 г. doi: 10.1021/acs.bioconjchem.8b00093 .
АВТОРЫ
Meng F 1 , Kassa T , Kassa T 1 , Jana S 1 , дерево F 1 , Чжан х 1 , JIA y 1 , д’Агнильо F 1 , Alayash Ai 1 .
Лаборатория биохимии и сосудистой биологии, Отдел компонентов и устройств крови, Центр оценки и исследований биологических препаратов, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, Силвер-Спринг, Мэриленд 20993, США
*Электронная почта: abdu. [email protected].
[email protected].
Текущее содержание:
Оценка безопасности и эффективности заменителей крови на основе гемоглобина
Главный исследователь: А.Алаяш И., к.м.н.
Офис/Отдел/Лаборатория: ОБРР/ДБКД/ЛБВБ
Общий обзор
Разработка безопасного и эффективного кровезаменителя значительно улучшит неотложную помощь пострадавшим от несчастных случаев и раненым солдатам, а также пациентам, перенесшим операцию на сердце, особенно в условиях нехватки цельной крови.
Один из видов искусственного кровезаменителя, который широко изучался учеными, называется «переносчик кислорода на основе гемоглобина» (HBOC).HBOC используют естественную молекулу, переносящую кислород, называемую гемоглобином (Hb), для переноса кислорода по всему телу. Однако, поскольку Hb, используемый для HBOC, не находится внутри эритроцитов, он имеет тенденцию накапливаться в крови до токсических уровней. Этот бесклеточный гемоглобин может вызывать высокое кровяное давление; Hb также может выходить из кровеносных сосудов и повреждать почки и другие органы. Таким образом, FDA не одобрило HBOC для использования в Соединенных Штатах, и регулирующие органы большинства других стран также не одобрили HBOC.
Наша лаборатория пытается решить проблему токсичности гемоглобина, чтобы промышленность могла производить безопасные и эффективные HBOC. Мы изучаем, как свободный Hb вызывает свои токсические эффекты, и разрабатываем способы предотвращения этих эффектов.
Ранее мы опубликовали результаты исследования на животных моделях, показавшие, что молекула под названием гаптоглобин, обнаруженная в крови, может связываться с гемоглобином, предотвращая его повреждение. Гаптоглобин оказывал благотворное влияние либо при непосредственном введении животным, либо при лечении животных препаратом, повышающим выработку гаптоглобина в организме.Эти данные свидетельствуют о том, что можно разработать более безопасные HBOC, поскольку Hb, связанный с гаптоглобином, все еще может переносить кислород и отдавать его тканям.
Гаптоглобин оказывал благотворное влияние либо при непосредственном введении животным, либо при лечении животных препаратом, повышающим выработку гаптоглобина в организме.Эти данные свидетельствуют о том, что можно разработать более безопасные HBOC, поскольку Hb, связанный с гаптоглобином, все еще может переносить кислород и отдавать его тканям.
Наша работа вносит вклад в нормативные и исследовательские усилия CBER по поддержке разработки безопасных и эффективных продуктов, улучшающих здоровье населения в США и во всем мире.
Научный обзор
HBOC имеют много потенциальных преимуществ по сравнению с кровью человека, включая доступность, совместимость и длительное хранение.Однако они также вызывают ряд опасений, включая токсичность. Несколько крупных производителей недавно прекратили свои клинические испытания в США из-за значительного увеличения числа побочных эффектов у пациентов, которым вводили доступные в настоящее время исследуемые продукты HBOC.
В центре внимания исследований секции биохимии гемоглобина (Hb) на основе заменителей находится структурно-функциональная характеристика модифицированного гемоглобина в отношении его окислительно-восстановительного (восстановительно-окислительного) химического состава и токсичности.В частности, мы изучаем потенциальный вклад реактивных промежуточных соединений на основе гемоглобина в окислительные и сигнальные каскады как in vitro, так и in vivo. Мы также изучаем несколько потенциальных молекулярных вмешательств для прямого или косвенного преодоления токсичности гемоглобина in vitro и in vivo.
Основа токсичности HBOC плохо изучена; поскольку большая часть исследований, проводимых промышленностью, является частной собственностью, и между исследователями происходит лишь минимальный обмен информацией. Наш основной вклад в область HBOC включает: 1) определение токсикологических путей, которые возникают и управляются простетической группой гема молекулы; 2) разработка защитных молекулярных стратегий для подавления или контроля окислительных побочных реакций гемоглобина; 3) корреляция гемоглобина и его различных окислительно-восстановительных состояний и оксигенации с экспрессией фактора, индуцируемого гипоксией (HIF-1альфа), «датчика кислорода» и других генов, чувствительных к гипоксии, в модели обменного переливания крови; и 4) определение сайт-специфического характера взаимодействия между гаптоглобином (Hp) и Hb, которое является основой пути клиренса Hb в макрофагах человека. Совсем недавно мы обнаружили функции Hp в контроле эффектов артериального давления, которые не только представляют собой новую парадигму исследований кровезаменителей, но также могут иметь клиническое применение при лечении гемолитических анемий.
Совсем недавно мы обнаружили функции Hp в контроле эффектов артериального давления, которые не только представляют собой новую парадигму исследований кровезаменителей, но также могут иметь клиническое применение при лечении гемолитических анемий.
Наше целенаправленное лабораторное исследование по оценке безопасности и эффективности HBOC было опубликовано в крупных рецензируемых журналах и представлено на национальных и международных встречах.
Публикации
- Shock 2019 Oct;52(1S Доп.1):41-9
Механизмы токсичности и модуляции переносчиков кислорода на основе гемоглобина (HBOC).
Алаяш АИ - Free Radic Biol Med 2019 Sep;141:348-61
Окислительно-восстановительные состояния гемоглобина определяют восстановление давления в левом желудочке и активность митохондриального комплекса IV в гипоксическом сердце крыс.
Эдмондсон М., Яна С., Мэн Ф., Стрейдер М.Б., Бэк Дж.Х., Гао И., Бюлер П.В., Алаяш А. И.
И. - Front Physiol 2019 Jul 24;10:931
Противосудорожные препараты, нацеленные на бетаCys93, снижают окисление железа и окислительные изменения в серповидноклеточном гемоглобине.
Касса Т., Вуд Ф., Стрейдер М.Б., Алаяш А.И. - Am J Hematol 2019 Apr;94(4):E88-90
Лечение вокселотором пациента с серповидно-клеточной анемией и очень тяжелой анемией.
Шет А.С., Мендельсон Л., Харпер Дж., Островски Д., Генри Э.Р., Гваабе Э., Николс Дж., Алаяш А.И., Итон В.А., Тейн С.Л. - J Biol Chem 2019 Mar 15;294(11):4145-59
Замены в бета-субъединицах серповидноклеточного гемоглобина улучшают окислительную стабильность и увеличивают время задержки образования серповидноклеточных волокон.
Мэн Ф., Касса Т., Стрейдер М.Б., Соман Дж., Олсон Дж.С., Алаяш А.И. - Bioconjug Chem 20 марта 2019 г.; 30(3):568-71
Взаимодействие препарата против серповидности с гемоглобином в эритроцитах пациента с серповидноклеточной анемией.
Страдер М.Б., Лян Х., Мэн Ф., Харпер Дж., Островски Д.А., Генри Э.Р., Шет А.С., Итон В.А., Тейн С.Л., Алаяш А.И. - JCI Insight 2018 Nov 2;3(21):e120451
Реакции, зависящие от окисления гемоглобина, способствуют взаимодействию с полосой 3 и окислительным изменениям в микрочастицах, полученных из серповидных клеток.
Яна С., Страдер М.Б., Менг Ф., Хикс В., Касса Т., Тарандовский И., Де Паоли С., Саймак Дж., Хэвен М.Р., Белчер Д.Д., Верчеллотти Г.М., Алаяш А.И. - Cell Mol Life Sci 2018 Oct;75(20):3781-801
Анализ биохимической архитектуры и морфологических путей высвобождения внеклеточного везикулома тромбоцитов человека.
Де Паоли С.Х., Тегегн Т.З., Эльхелу О.К., Страдер М.Б., Патель М., Дидух Л.Л., Тарандовский И.Д., У Ю, Чжэн Дж., Ованесов М.В., Алаяш А., Симак Дж. - Redox Biol 2018 Aug 22;19:218-25
Сайт-направленный мутагенез остатков цистеина изменяет окислительную стабильность фетального гемоглобина.
Кеттисен К., Страдер М.Б., Вуд Ф., Алаяш А.И., Бюлов Л. - Biosci Rep 2018 Jul 2;38(4):BSR20180370
Сравнение окислительной реактивности рекомбинантного гемоглобина плода и взрослого человека: значение для разработки переносчиков кислорода на основе гемоглобина.
Саймонс М., Греттон С., Силкстоун Г.Г.А., Раджагопал Б.С., Аллен-Боме В., Сиретт Н., Шайк Т., Лейва-Эрикссон Н., Ронда Л., Моцарелли А., Стрейдер М.Б., Алаяш А.И., Ридер Б.Дж., Купер CE - Клетки крови Mol Dis 2018 May;70:78-86
Окислительные пути в серповидноклеточной клетке и за ее пределами.
Алаяш АИ - Bioconjug Chem 2018 May 16;29(5):1560-75
Комплексная биохимическая и биофизическая характеристика терапевтических кислородсодержащих носителей на основе гемоглобина: не все HBOC созданы одинаково.
Мэн Ф., Касса Т., Яна С., Вуд Ф., Чжан С., Цзя И., Д’Аньилло Ф., Алаяш А.И. - Transfusion 2018 Jan;58(1):255-66
Материалы открытого семинара Управления по санитарному надзору за качеством пищевых продуктов и медикаментов по новым наукам о регулировании продуктов эритроцитов 2016.
Vostal JG, Buehler PW, Gelderman MP, Alayash AI, Doctor A, Zimring JC, Glynn SA, Hess JR, Klein H, Acker JP, Spinella PC, D’Alessandro A, Palsson B, Raife TJ, Busch MP, McMahon TJ, Intaglietta M, Swartz HM, Dubick MA, Cardin S, Patel RP, Natanson C, Weisel JW, Muszynski JA, Norris PJ, Ness PM - Biochem J 2017 Dec 11;474(24):4171-92
Разработка устойчивости к окислению гемоглобина человека на основе мутации Hb Providence (betaK82D) и генетического перекрестного связывания.
Страдер М.Б., Бэнгл Р., Паркер Сибурт К.Дж., Варнадо К.Л., Соман Дж., Бенитес Карденас А.С., Сэмюэл П.С., Синглтон Э.В., Крамблисс А.Л., Олсон Д.С., Алаяш А.И. - Front Physiol 2017 Dec 19;8:1082
Окисленные мутантные гемоглобины S и E человека вызывают окислительный стресс и биоэнергетическую дисфункцию в эндотелиальных клетках легких человека.
Яна С., Мэн Ф., Хирш Р.Э., Фридман Дж.М., Алаяш А.И. - Metalromics 2017 Sep 20;9(9):1260-70
Нацеливание на бетаCys93 в гемоглобине S с помощью агента против серповидности, обладающего двойным аллостерическим и антиоксидантным действием.
Касса Т., Брэд Стрейдер М., Накагава А., Запол В.М., Алаяш А.И. - Antioxid Redox Signal 10 мая 2017 г .; 26 (14): 777-93
Изучение окислительных реакций в вариантах гемоглобина с использованием масс-спектрометрии: уроки по разработке устойчивых к окислению кислородных препаратов.
Страдер М.Б., Алаяш А.И. - Antioxid Redox Signal 2017 May 10;26(14):745-7
Редокс-химия нарушений, связанных с гемоглобином.
Булов Л, Алаяш АИ - Nat Struct Mol Biol 2017 Apr;24(4):379-86
Белок Tat ВИЧ и бета-амилоидный пептид образуют мультифибриллярные структуры, вызывающие нейротоксичность.
Хатеган А., Бьянше М.А., Штайнер Дж., Карнаухова Э., Маслия Э., Филдс А., Ли М.Х., Диккенс А.М., Хоги Н., Димитриадис Э.К., Нат А. - Anal Biochem 2017 Mar 15;521:11-9
Определение коэффициентов экстинкции человеческого гемоглобина в различных окислительно-восстановительных состояниях.
Мэн Ф., Алаяш А.И. - Biomolecules 2017 Jan 4;7(1):7010002
Кровезаменители на основе гемоглобина и лечение серповидно-клеточной анемии: больше вреда, чем помощи?
Алаяш АИ - PLoS One 2016 Dec 13;11(12):e0166657
Оценка эритроцитов, полученных из стволовых клеток, в качестве трансфузионного продукта с использованием новой модели на животных.
Шах С., Гелдерман М.П., Льюис М.А., Фаррел Дж., Вуд Ф., Стрейдер М.Б., Алаяш А.И., Востал Дж.Г. - Br J Haematol 2016 Nov;175(4):714-23
Длительное лечение серповидноклеточных мышей гаптоглобином увеличивает экспрессию HO-1 и H-ферритина и уменьшает отложение железа в почках без улучшения функции почек.
Ши П.А., Чой Э., Чинтагари Н.Р., Нгуен Дж., Го Х, Язданбахш К., Мохандас Н., Алаяш А.И., Манси Э.А., Белчер Д.Д., Верчеллотти Г.М. - Am J Respir Cell Mol Biol 2016 Aug;55(2):288-98
Окисленные трехвалентные и ферриловые формы гемоглобина вызывают митохондриальную дисфункцию и повреждение альвеолярных клеток I типа.
Чинтагари Н.Р., Яна С., Алаяш А.И. - Redox Biol 2016 Aug;8:363-74
Окислительная нестабильность гемоглобина E (beta26 Glu—>Lys) увеличивается в присутствии свободных альфа-субъединиц и устраняется белком, стабилизирующим альфа-гемоглобин (AHSP): отношение к HbE /бета-талассемия.
Страдер М.Б., Касса Т., Мэн Ф., Вуд Ф.Б., Хирш Р.Э., Фридман Дж.М., Алаяш А.И. - FEBS Open Bio 2016 Aug 8;6(9):876-84
Дифференциальное высвобождение гема из различных окислительно-восстановительных состояний гемоглобина и активация клеточной гемоксигеназы-1.
Касса Т., Яна С., Мэн Ф., Алаяш А.И. - Biochemistry 2016 Jan 12;55(1):133-45
Рассказы о связывании дигидрофолата с дигидрофолатредуктазой R67.
Дафф М.Р. младший, Чопра С., Стрейдер М.Б., Агарвал П.К., Хауэлл EE - J Biol Chem 2015 Nov 13;290(46):27939-58
Серповидноклеточный гемоглобин в феррил-состоянии способствует окислению бетаCys93 и митохондриальной дисфункции в эпителиальных клетках легких (E10).
Касса Т., Яна С., Стрейдер М.Б., Мэн Ф., Цзя И., Уилсон М.Т., Алаяш А.И. - Front Physiol 2015 Feb 20;6:39
Вскрытие радикальных реакций, связанных с фетальным гемоглобином, выявило повышенную активность псевдопероксидазы.
Ратанасова К., Страдер М.Б., Алаяш А.И., Бюлов Л.
Текущее содержание:
СОСТОЯНИЕ СОВРЕМЕННОСТИ И НОВЫЕ МОЛЕКУЛЫ
В суровых условиях поля боя и в отдаленных районах неконтролируемое кровотечение, связанное с травмой, и острая коагулопатия остаются одной из основных причин смертности (1–6).В таких сценариях переливание цельной крови и компонентов крови (например, эритроцитов, тромбоцитов и плазмы) в соответствии с рекомендациями по реанимации с контролем повреждений может значительно снизить заболеваемость и смертность, связанные с травмами (7–9). Однако ограниченная доступность и портативность, особые требования к хранению и высокий риск контаминации этих продуктов крови часто создают серьезные логистические проблемы для их догоспитального применения в военных и гражданских сценариях, для немедленного и длительного лечения в месте повреждения (т.г., в пути) полевой уход (10–17). В настоящее время проводится большой объем исследований, направленных на решение этих проблем и повышение доступности и применимости продуктов донорской крови в полевых условиях (18–21). Параллельно с этим возникла захватывающая область исследований, которая сосредоточена на разработке и оценке полусинтетических или синтетических заменителей продуктов крови, которые можно производить в больших масштабах in vitro (т. е. при достаточной доступности), можно стерилизовать и хранить в небольших объемах. в течение длительных периодов времени при различных температурных диапазонах (т.д., легкая переносимость), могут быть восстановлены и введены «по требованию» в далеко зашедших сценариях (т.
Однако ограниченная доступность и портативность, особые требования к хранению и высокий риск контаминации этих продуктов крови часто создают серьезные логистические проблемы для их догоспитального применения в военных и гражданских сценариях, для немедленного и длительного лечения в месте повреждения (т.г., в пути) полевой уход (10–17). В настоящее время проводится большой объем исследований, направленных на решение этих проблем и повышение доступности и применимости продуктов донорской крови в полевых условиях (18–21). Параллельно с этим возникла захватывающая область исследований, которая сосредоточена на разработке и оценке полусинтетических или синтетических заменителей продуктов крови, которые можно производить в больших масштабах in vitro (т. е. при достаточной доступности), можно стерилизовать и хранить в небольших объемах. в течение длительных периодов времени при различных температурных диапазонах (т.д., легкая переносимость), могут быть восстановлены и введены «по требованию» в далеко зашедших сценариях (т. е. догоспитальная применимость), могут потенциально избежать необходимости сопоставления типов (универсальное применение с минимальным иммуногенным риском), могут безопасно циркулировать при внутрисосудистом введении без системных рисков и может имитировать, усиливать и усиливать эндогенные механизмы функционирования компонентов крови для смягчения последствий травматического обескровливающего кровотечения (22–24). Эта область исследований развивалась в области функциональной имитации клеточных, а также неклеточных компонентов крови и по-прежнему сосредоточена на решении трансляционных задач в отношении биосовместимости, безопасности, догоспитальной доступности и универсальности.
е. догоспитальная применимость), могут потенциально избежать необходимости сопоставления типов (универсальное применение с минимальным иммуногенным риском), могут безопасно циркулировать при внутрисосудистом введении без системных рисков и может имитировать, усиливать и усиливать эндогенные механизмы функционирования компонентов крови для смягчения последствий травматического обескровливающего кровотечения (22–24). Эта область исследований развивалась в области функциональной имитации клеточных, а также неклеточных компонентов крови и по-прежнему сосредоточена на решении трансляционных задач в отношении биосовместимости, безопасности, догоспитальной доступности и универсальности.
Исследования по сохранению и транспортировке донорской крови начались во время Первой мировой войны для лечения раненых солдат, а переливание крови стало широко доступным во время Второй мировой войны. С 1950-х годов в Соединенных Штатах было создано несколько банков крови, и донорство крови пропагандировалось как форма гражданской ответственности. Последующая разработка процессов и методологий выделения и хранения различных компонентов крови значительно расширила использование цельной крови и ее компонентов.В настоящее время переливание цельной крови, а также различных изолированных компонентов клинически одобрено для применения при травмах среди гражданского населения и на полях сражений (например, при реанимации с целью контроля повреждений), хирургических вмешательствах (например, при трансплантации), хронических и острых анемиях, а также связанных с заболеванием наркоманиях. индуцированные или врожденные нарушения свертываемости крови (25–32). Переливание эритроцитов имеет клиническое значение для эффективного смягчения геморрагического шока в рамках протокола массивной трансфузии у пациентов с гипоперфузией и критическими уровнями кислорода (33–37).Также было продемонстрировано, что переливание эритроцитарной массы на догоспитальном этапе (если возможно) может значительно улучшить выживаемость пациентов с критическими травмами (38, 39).
Последующая разработка процессов и методологий выделения и хранения различных компонентов крови значительно расширила использование цельной крови и ее компонентов.В настоящее время переливание цельной крови, а также различных изолированных компонентов клинически одобрено для применения при травмах среди гражданского населения и на полях сражений (например, при реанимации с целью контроля повреждений), хирургических вмешательствах (например, при трансплантации), хронических и острых анемиях, а также связанных с заболеванием наркоманиях. индуцированные или врожденные нарушения свертываемости крови (25–32). Переливание эритроцитов имеет клиническое значение для эффективного смягчения геморрагического шока в рамках протокола массивной трансфузии у пациентов с гипоперфузией и критическими уровнями кислорода (33–37).Также было продемонстрировано, что переливание эритроцитарной массы на догоспитальном этапе (если возможно) может значительно улучшить выживаемость пациентов с критическими травмами (38, 39). Такие переливания зависят от продуктов донорских эритроцитов (например, эритроцитарной массы [pRBC]). Однако, по данным Красного Креста, только ~ 40% населения США имеют право сдавать кровь в любой момент времени, и только от 10% до 15% действительно сдают кровь. Кроме того, продукты на основе крови имеют несколько ограниченный срок хранения из-за риска патогенного заражения.В настоящее время срок годности эритроцитов составляет от 20 до 40 дней, тогда как срок хранения суспензий тромбоцитов составляет от 3 до 5 дней при комнатной температуре (40). Кроме того, в эритроцитах (и тромбоцитах) при хранении развиваются повреждения, которые влияют на их стабильность, продолжительность циркуляции in vivo и биоактивные функции (41, 42). Проводятся значительные исследования по увеличению срока годности продуктов крови путем хранения в холодильнике, замораживания, лиофилизации и т. д., а также путем разработки технологий снижения патогенности, таких как ультрафиолетовое облучение на основе псоралена или рибофлавина, обширные серологические исследования.
Такие переливания зависят от продуктов донорских эритроцитов (например, эритроцитарной массы [pRBC]). Однако, по данным Красного Креста, только ~ 40% населения США имеют право сдавать кровь в любой момент времени, и только от 10% до 15% действительно сдают кровь. Кроме того, продукты на основе крови имеют несколько ограниченный срок хранения из-за риска патогенного заражения.В настоящее время срок годности эритроцитов составляет от 20 до 40 дней, тогда как срок хранения суспензий тромбоцитов составляет от 3 до 5 дней при комнатной температуре (40). Кроме того, в эритроцитах (и тромбоцитах) при хранении развиваются повреждения, которые влияют на их стабильность, продолжительность циркуляции in vivo и биоактивные функции (41, 42). Проводятся значительные исследования по увеличению срока годности продуктов крови путем хранения в холодильнике, замораживания, лиофилизации и т. д., а также путем разработки технологий снижения патогенности, таких как ультрафиолетовое облучение на основе псоралена или рибофлавина, обширные серологические исследования. тестирование донорской крови, лейкоредукция и специальные протоколы хранения (13, 19, 31, 43–48).Кроме того, транспортировка продуктов крови, особенно на удаленные поля боевых действий и в гражданские районы, особенно для догоспитального использования в пунктах оказания медицинской помощи, продолжает оставаться серьезной логистической проблемой (14, 17, 49).
тестирование донорской крови, лейкоредукция и специальные протоколы хранения (13, 19, 31, 43–48).Кроме того, транспортировка продуктов крови, особенно на удаленные поля боевых действий и в гражданские районы, особенно для догоспитального использования в пунктах оказания медицинской помощи, продолжает оставаться серьезной логистической проблемой (14, 17, 49).
Такие проблемы потенциально могут быть решены путем разработки полусинтетических или синтетических заменителей компонентов крови (22, 50, 51). На самом деле, интерес к таким синтетическим заменителям возник во время кризиса ВИЧ 1980-х годов из-за страха перед зараженными продуктами крови (4), и это исследование продолжалось в течение последних нескольких десятилетий, с несколькими разработками и продуктами, которые прошли доклинические и клинические оценки.Однако в настоящее время ни один такой продукт не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для применения человеком в Соединенных Штатах, хотя некоторые продукты были одобрены для использования человеком в Южной Африке и в ветеринарии в Соединенных Штатах. Метаанализ 2008 г. 16 клинических испытаний пяти различных заменителей эритроцитов показал повышенный риск для здоровья у пациентов, получавших такие продукты (52). Несмотря на то, что такой анализ привел к некоторым опасениям в отношении клинической безопасности и полезности этих продуктов, дизайн этого анализа активно обсуждался, и он также направил значительный новый акцент на понимание плюсов и минусов этих продуктов на фундаментальном физиологическом и механистическом уровнях. .С этой целью текущая категоризация таких продуктов была изменена с «заменителей эритроцитов» на «оксигенирующие терапевтические средства», чтобы подчеркнуть важную роль таких продуктов в сценариях, где настоящие эритроциты могут быть недостаточно доступны (например, далеко передовые военные действия). а также при перфузии трансплантируемых органов. В этой связи текущая статья будет посвящена обзору «переносчиков кислорода на основе гемоглобина» (HBOC), всестороннему обсуждению соответствующих конструкций, современного состояния и новых молекул, находящихся в разработке, а также подчеркиванию успехов и проблем.
Метаанализ 2008 г. 16 клинических испытаний пяти различных заменителей эритроцитов показал повышенный риск для здоровья у пациентов, получавших такие продукты (52). Несмотря на то, что такой анализ привел к некоторым опасениям в отношении клинической безопасности и полезности этих продуктов, дизайн этого анализа активно обсуждался, и он также направил значительный новый акцент на понимание плюсов и минусов этих продуктов на фундаментальном физиологическом и механистическом уровнях. .С этой целью текущая категоризация таких продуктов была изменена с «заменителей эритроцитов» на «оксигенирующие терапевтические средства», чтобы подчеркнуть важную роль таких продуктов в сценариях, где настоящие эритроциты могут быть недостаточно доступны (например, далеко передовые военные действия). а также при перфузии трансплантируемых органов. В этой связи текущая статья будет посвящена обзору «переносчиков кислорода на основе гемоглобина» (HBOC), всестороннему обсуждению соответствующих конструкций, современного состояния и новых молекул, находящихся в разработке, а также подчеркиванию успехов и проблем. С этой целью будут подчеркнуты репрезентативные доклинические и клинические результаты, но не будут всесторонне обсуждаться результаты in vitro и in vivo отдельных дизайнов.
С этой целью будут подчеркнуты репрезентативные доклинические и клинические результаты, но не будут всесторонне обсуждаться результаты in vitro и in vivo отдельных дизайнов.
Функция гемоглобина (Hb) в эритроцитах по транспорту кислорода
В крови основной функцией эритроцитов является транспорт кислорода (O 2 ) и в некоторой степени диоксида углерода в ткани и из них за счет связывания газов в гемоглобин (Hb) в эритроцитах. Среднее количество Hb в эритроцитах взрослого человека (средний корпускулярный гемоглобин [MCH]) составляет от 27 до 31 пикограмм на клетку (~ 250 миллионов молекул Hb).Hb представляет собой тетрамерный белок, состоящий из двух α- и двух β-полипептидных цепей, каждая из которых состоит из железосодержащей гемовой группы, способной связывать одну молекулу кислорода (O 2 ). показывает многомасштабное представление эритроцитов, гемоглобина в эритроцитах и химической структуры железосодержащей «гемовой» группы в гемоглобине. Кинетика связывания O 2 с гемоглобином является положительно кооперативной, так что небольшое изменение парциального давления кислорода по мере того, как кровь движется от легких к тканям (), может привести к большим изменениям связанного (в легких) или высвобожденного (в ткани) кислорода. по Hb, как показано классической сигмоидальной формой кривой равновесия O 2 -связывания (OEC, ) (53, 54).Железо, содержащее O 2 в Hb, находится в восстановленном «железистом» состоянии (Fe 2+ ). Когда Hb окисляется с образованием метгемоглобина (MetHb), железо окисляется до «трехвалентного» состояния (Fe 3+ ), которое не способно связывать кислород (55). По этой причине в естественных эритроцитах механизм переноса кислорода Hb тесно связан с окислительно-восстановительными циклами (например, под действием фермента NAD-цитохром b5 редуктазы), так что Fe 2+ -содержащий Hb может поддерживаться в его O 2 — состояние привязки.
Кинетика связывания O 2 с гемоглобином является положительно кооперативной, так что небольшое изменение парциального давления кислорода по мере того, как кровь движется от легких к тканям (), может привести к большим изменениям связанного (в легких) или высвобожденного (в ткани) кислорода. по Hb, как показано классической сигмоидальной формой кривой равновесия O 2 -связывания (OEC, ) (53, 54).Железо, содержащее O 2 в Hb, находится в восстановленном «железистом» состоянии (Fe 2+ ). Когда Hb окисляется с образованием метгемоглобина (MetHb), железо окисляется до «трехвалентного» состояния (Fe 3+ ), которое не способно связывать кислород (55). По этой причине в естественных эритроцитах механизм переноса кислорода Hb тесно связан с окислительно-восстановительными циклами (например, под действием фермента NAD-цитохром b5 редуктазы), так что Fe 2+ -содержащий Hb может поддерживаться в его O 2 — состояние привязки. Необратимое превращение Hb в MetHb не только угнетает его кислородную способность, но и приводит к нарушению регуляции сосудистого тонуса и воспалительным реакциям. Кроме того, гемоглобин в эритроцитах обладает уникальной способностью претерпевать конформационные изменения, чтобы обеспечить насыщение (загрузку) O 2 в легких (более высокое сродство O 2 ), а затем высвобождение O 2 в тканевых капиллярах (более низкое O 2 сходство). Эта обратимая конформационная регуляция аффинности связывания O 2 с Hb поддерживается аллостерическими эффекторными молекулами, такими как 2,3-дифосфоглицерат (2,3-DPG), который образуется внутри эритроцитов в качестве промежуточного гликолитического соединения.Следовательно, поддержание термодинамических и кинетических характеристик гемоглобина, несущих кислород, поддержание окислительно-восстановительной среды и минимизация необратимого образования MetHb являются одними из важных и сложных соображений дизайна в контексте разработки суррогата эритроцитов на основе гемоглобина (56).
Необратимое превращение Hb в MetHb не только угнетает его кислородную способность, но и приводит к нарушению регуляции сосудистого тонуса и воспалительным реакциям. Кроме того, гемоглобин в эритроцитах обладает уникальной способностью претерпевать конформационные изменения, чтобы обеспечить насыщение (загрузку) O 2 в легких (более высокое сродство O 2 ), а затем высвобождение O 2 в тканевых капиллярах (более низкое O 2 сходство). Эта обратимая конформационная регуляция аффинности связывания O 2 с Hb поддерживается аллостерическими эффекторными молекулами, такими как 2,3-дифосфоглицерат (2,3-DPG), который образуется внутри эритроцитов в качестве промежуточного гликолитического соединения.Следовательно, поддержание термодинамических и кинетических характеристик гемоглобина, несущих кислород, поддержание окислительно-восстановительной среды и минимизация необратимого образования MetHb являются одними из важных и сложных соображений дизайна в контексте разработки суррогата эритроцитов на основе гемоглобина (56). В этом контексте важным фактором является поддержание физико-химической стабильности гемоглобина, поскольку вне защитного окружения эритроцитов (т. е. вне клеток или стромы) тетрамер гемоглобина склонен к быстрому распаду на димерные и мономерные белковые единицы, которые в свою очередь приводит к быстрому выведению из кровотока во внесосудистое пространство и почки.Это приводит к очень короткому времени пребывания в циркуляции и повышенному риску нефротоксичности. Hb без стромы также лишен регуляторных ферментов сродства к кислороду, таких как 2,3-DPG, а также защитных антиоксидантных ферментов. В результате такой гемоглобин имеет нарушенную способность оксигенации тканей по сравнению с гемоглобином, инкапсулированным в эритроциты, а также склонен к быстрому необратимому окислению до MetHb, тем самым теряя способность транспортировать кислород. Свободный от стромы гемоглобин также является мощным поглотителем как внутри-, так и внесосудистого оксида азота (NO), который вырабатывается сосудистыми эндотелиальными клетками для врожденной вазодилататорной функции, и это связано с гипертоническими побочными эффектами гемоглобина.
В этом контексте важным фактором является поддержание физико-химической стабильности гемоглобина, поскольку вне защитного окружения эритроцитов (т. е. вне клеток или стромы) тетрамер гемоглобина склонен к быстрому распаду на димерные и мономерные белковые единицы, которые в свою очередь приводит к быстрому выведению из кровотока во внесосудистое пространство и почки.Это приводит к очень короткому времени пребывания в циркуляции и повышенному риску нефротоксичности. Hb без стромы также лишен регуляторных ферментов сродства к кислороду, таких как 2,3-DPG, а также защитных антиоксидантных ферментов. В результате такой гемоглобин имеет нарушенную способность оксигенации тканей по сравнению с гемоглобином, инкапсулированным в эритроциты, а также склонен к быстрому необратимому окислению до MetHb, тем самым теряя способность транспортировать кислород. Свободный от стромы гемоглобин также является мощным поглотителем как внутри-, так и внесосудистого оксида азота (NO), который вырабатывается сосудистыми эндотелиальными клетками для врожденной вазодилататорной функции, и это связано с гипертоническими побочными эффектами гемоглобина. Таким образом, обеспечение эффективной оксигенации тканей при поддержании разумного времени циркуляции, минимизация гипертензивных побочных эффектов и предотвращение токсичности, вызванной гемоглобином, являются тремя основными требованиями к конструкции HBOC. В следующих разделах рассматриваются и обсуждаются различные подходы к проектированию, направленные на удовлетворение этих требований.
Таким образом, обеспечение эффективной оксигенации тканей при поддержании разумного времени циркуляции, минимизация гипертензивных побочных эффектов и предотвращение токсичности, вызванной гемоглобином, являются тремя основными требованиями к конструкции HBOC. В следующих разделах рассматриваются и обсуждаются различные подходы к проектированию, направленные на удовлетворение этих требований.
B. На нем показана схема движения эритроцитов между легкими (участок насыщения кислородом) и тканью (участок сброса кислорода), а (C) показаны соответствующие характеристики кривой кислородного равновесия (OEC) Hb. RBCs указывает на эритроциты.
Системы переносчиков кислорода (HBOC) на основе Hb
HBOC представляют собой полусинтетические системы, в которых природный Hb используется в качестве переносящего кислород компонента, либо в виде химически модифицированных бесклеточных суспензий, либо конъюгированных и сшитых с полимерами вместе с защитными ферментами, или инкапсулированные в носителях из микро- или наночастиц (51, 57).Hb, используемый в этих системах, обычно получают из устаревших человеческих или бычьих эритроцитов или из рекомбинантных источников (57–63). В случае устаревших человеческих или бычьих эритроцитов Hb выделяют путем лизиса клеток, очищают с помощью стерильной фильтрации и хроматографических методов и стерилизуют (например, при слабом нагревании) (64). Использование бесклеточного гемоглобина имеет преимущество минимальной антигенности и способности более эффективно выводить кислород из плазмы из-за отсутствия помех со стороны клеточной мембраны. Фактически, по сообщениям, в начале 20 века суспензия бесклеточного гемоглобина в растворе Рингера с лактатом использовалась для внутривенного лечения 15 пациентов; однако у большого числа из них развилась нефротоксичность и сердечно-сосудистые осложнения (64). Подобные результаты были также получены в 1950-х годах, когда ВМС США лечили нескольких пациентов с бесклеточным гемоглобином (65). Также было обнаружено, что бесклеточный Hb имеет очень короткое время пребывания в циркуляции, поскольку тетрамер Hb быстро диссоциирует на димерные и мономерные формы, которые могут связываться с иммуноглобулинами плазмы и подвергаться быстрому клиренсу ретикуло-эндотелиальной системой в селезенку и печень, а также как почечный клиренс в почки, что приводит к индуцированной гемоглобином токсичности в этих органах (66, 67). Кроме того, бесклеточный Hb и его диссоциированные производные также могут проникать в субэндотелиальный домен кровеносной системы и быстро связывать NO, что приводит к его превращению в нитрат (реакция диоксигенации) и окси-Hb в Met-Hb (68).NO является естественным сосудорасширяющим средством организма, и, следовательно, удаление NO приводит к вазоконстрикции и сердечно-сосудистым осложнениям. Кроме того, отсутствие 2,3-DPG в бесклеточном гемоглобине может вызвать неестественно высокое сродство к кислороду, что делает проблематичным разгрузку O 2 .
Подобные результаты были также получены в 1950-х годах, когда ВМС США лечили нескольких пациентов с бесклеточным гемоглобином (65). Также было обнаружено, что бесклеточный Hb имеет очень короткое время пребывания в циркуляции, поскольку тетрамер Hb быстро диссоциирует на димерные и мономерные формы, которые могут связываться с иммуноглобулинами плазмы и подвергаться быстрому клиренсу ретикуло-эндотелиальной системой в селезенку и печень, а также как почечный клиренс в почки, что приводит к индуцированной гемоглобином токсичности в этих органах (66, 67). Кроме того, бесклеточный Hb и его диссоциированные производные также могут проникать в субэндотелиальный домен кровеносной системы и быстро связывать NO, что приводит к его превращению в нитрат (реакция диоксигенации) и окси-Hb в Met-Hb (68).NO является естественным сосудорасширяющим средством организма, и, следовательно, удаление NO приводит к вазоконстрикции и сердечно-сосудистым осложнениям. Кроме того, отсутствие 2,3-DPG в бесклеточном гемоглобине может вызвать неестественно высокое сродство к кислороду, что делает проблематичным разгрузку O 2 . Бесклеточный Hb также может изменять осмолярность крови, что приводит к изменению объема крови и связанным с этим побочным эффектам. В целом, по этим причинам бесклеточный гемоглобин человека считается проблематичным для in vivo приложений, несущих кислород.Вместо человеческого гемоглобина исследования также проводились с бычьим гемоглобином, но это также связано с аналогичными проблемами стабильности, экстравазации, удаления NO, почечного клиренса и токсичности. Еще одним интересным способом решения некоторых из этих проблем является разработка рекомбинантного гемоглобина (например, в E coli) , где специфические мутации могут способствовать уменьшению диссоциации и модуляции способности связывания NO, но правильная комбинация мутаций, которые могут привести к идеальный дизайн гемоглобина еще предстоит установить (69–71).Рекомбинантные технологии также значительно дороже по сравнению с человеческим или бычьим Hb. Таким образом, значительный объем исследований был сосредоточен на стабилизации in vivo и функциональной модуляции гемоглобина с использованием химических модификаций, таких как сшивка, полимеризация и конъюгация поверхности макромеров.
Бесклеточный Hb также может изменять осмолярность крови, что приводит к изменению объема крови и связанным с этим побочным эффектам. В целом, по этим причинам бесклеточный гемоглобин человека считается проблематичным для in vivo приложений, несущих кислород.Вместо человеческого гемоглобина исследования также проводились с бычьим гемоглобином, но это также связано с аналогичными проблемами стабильности, экстравазации, удаления NO, почечного клиренса и токсичности. Еще одним интересным способом решения некоторых из этих проблем является разработка рекомбинантного гемоглобина (например, в E coli) , где специфические мутации могут способствовать уменьшению диссоциации и модуляции способности связывания NO, но правильная комбинация мутаций, которые могут привести к идеальный дизайн гемоглобина еще предстоит установить (69–71).Рекомбинантные технологии также значительно дороже по сравнению с человеческим или бычьим Hb. Таким образом, значительный объем исследований был сосредоточен на стабилизации in vivo и функциональной модуляции гемоглобина с использованием химических модификаций, таких как сшивка, полимеризация и конъюгация поверхности макромеров. Целью этих модификаций является уменьшение диссоциации гемоглобина, его экстравазации и почечного клиренса при сохранении приемлемого времени жизни циркуляции и O 2 -транспортной способности.
Целью этих модификаций является уменьшение диссоциации гемоглобина, его экстравазации и почечного клиренса при сохранении приемлемого времени жизни циркуляции и O 2 -транспортной способности.
Химически модифицированные HBOC—
Hb может быть сшит как внутри-, так и межмолекулярно. Например, внутримолекулярное сшивание в человеческом гемоглобине, образованном между двумя его а-субъединицами с помощью ацилирования бис-(3,5-дибромсалицил)фумаратом (также известным как диаспирин), привело к получению продукта под названием HemAssist от Baxter (Чикаго, Иллинойс). 57, 72, 73). Этот продукт показал увеличение времени пребывания в кровотоке до 12 часов по сравнению с <6 часов для немодифицированного гемоглобина, но, к сожалению, перекрестно-сшитый гемоглобин показал 72-процентное увеличение уровня смертности у людей по сравнению с физиологическим раствором, и клинические испытания были прекращены (74). ).Аналогичный подход к перекрестному связыванию α-субъединиц рекомбинантного гемоглобина с использованием глицина привел к получению продукта под названием Optro от Somatogen (Boulder, Colo), но это также привело к повышенному риску остановки сердца и смертности (75–77). Вместо только сайт-специфического внутримолекулярного сшивания, полимеризованный гемоглобин также был создан с использованием бифункциональных сшивающих реагентов, таких как сшивка бычьего гемоглобина на основе глутарового альдегида (например, Hemopure первоначально от Biopure, Кембридж, Массачусетс, теперь HbO 2 Therapeutics). , Содертон, Пенсильвания) или Hb человека (e.g., PolyHeme от Northfield Labs, Эванстон, Иллинойс) и перекрестное связывание гемоглобина человека на основе о-рафинозы (например, продукт HemoLink от Hemosol, Торонто, Онтарио, Канада) (78, 79). Такое сшивание позволяет получить бесклеточный гемоглобин с более высокой молекулярной массой, который сохраняет свойства переноса кислорода, минимизируя при этом диссоциацию и быстрый клиренс гемоглобина. Одной из проблем этих подходов является точное регулирование молекулярной массы полимера, а для обеспечения качества продукта необходимы строгие этапы очистки. Сообщалось, что PolyHeme переходит в фазу III клинических испытаний в Соединенных Штатах для лечения кровопотери, связанной с травмой, и показал снижение потребности в естественных переливаниях крови (77).
Вместо только сайт-специфического внутримолекулярного сшивания, полимеризованный гемоглобин также был создан с использованием бифункциональных сшивающих реагентов, таких как сшивка бычьего гемоглобина на основе глутарового альдегида (например, Hemopure первоначально от Biopure, Кембридж, Массачусетс, теперь HbO 2 Therapeutics). , Содертон, Пенсильвания) или Hb человека (e.g., PolyHeme от Northfield Labs, Эванстон, Иллинойс) и перекрестное связывание гемоглобина человека на основе о-рафинозы (например, продукт HemoLink от Hemosol, Торонто, Онтарио, Канада) (78, 79). Такое сшивание позволяет получить бесклеточный гемоглобин с более высокой молекулярной массой, который сохраняет свойства переноса кислорода, минимизируя при этом диссоциацию и быстрый клиренс гемоглобина. Одной из проблем этих подходов является точное регулирование молекулярной массы полимера, а для обеспечения качества продукта необходимы строгие этапы очистки. Сообщалось, что PolyHeme переходит в фазу III клинических испытаний в Соединенных Штатах для лечения кровопотери, связанной с травмой, и показал снижение потребности в естественных переливаниях крови (77). Клинические испытания HemoPure также показали снижение потребности в дополнительных переливаниях крови при кардиохирургии (80). HemoPure получил клиническое одобрение в Южной Африке для лечения пациентов с острой анемией и проходит фазу III клинических испытаний в США. Аналогичный продукт той же компании (HbO 2 Therapeutics, США) под названием Oxyglobin в настоящее время одобрен в США для ветеринарного применения. Сообщается, что HemoLink также прошел клинические испытания фазы III, но был прекращен в 2003 году, когда у пациентов, получавших лечение, возникли неблагоприятные сердечные события.На самом деле, все эти продукты в своих клинических исследованиях продемонстрировали преходящую гипертензию различной степени, повреждение органов из-за сужения и дисфункции микрососудов, желудочно-кишечные расстройства, нефротоксичность, нейротоксичность и повышенную смертность (80–82).
Клинические испытания HemoPure также показали снижение потребности в дополнительных переливаниях крови при кардиохирургии (80). HemoPure получил клиническое одобрение в Южной Африке для лечения пациентов с острой анемией и проходит фазу III клинических испытаний в США. Аналогичный продукт той же компании (HbO 2 Therapeutics, США) под названием Oxyglobin в настоящее время одобрен в США для ветеринарного применения. Сообщается, что HemoLink также прошел клинические испытания фазы III, но был прекращен в 2003 году, когда у пациентов, получавших лечение, возникли неблагоприятные сердечные события.На самом деле, все эти продукты в своих клинических исследованиях продемонстрировали преходящую гипертензию различной степени, повреждение органов из-за сужения и дисфункции микрососудов, желудочно-кишечные расстройства, нефротоксичность, нейротоксичность и повышенную смертность (80–82).
Вместо внутримолекулярного сшивания и межмолекулярной полимеризации модификация гемоглобина также проводилась с помощью макромерной биоконъюгации для повышения стабильности и времени пребывания в сосудах при одновременном снижении распознавания иммунной системой (83–85). Важные примеры этого подхода можно найти в полиэтиленгликолевой (ПЭГ) модификации Hb (например, продукты Hemospan от Sangart Inc, Сан-Диего, Калифорния, и PEG-Hb от Enzon, South Plainfield, NJ) и поли(оксиэтиленовой) модификации Hb. пиридоксилированный сшитый Hb (например, продукт PHP от Apex Bioscience, Durham, NC). ПЭГ-илированные продукты гемоглобина прошли обширные клинические испытания, и исследования показали риск брадикардии и повышения активности печеночных ферментов поджелудочной железы даже при низких дозах (86).Тем не менее, клинические испытания Фазы I и Фазы II показали, что Гемоспан хорошо переносится людьми для эффективной доставки кислорода, а испытания Фазы III у пациентов ортопедической хирургии проводились в Европе. Испытания показали, что риск сердечно-сосудистых и почечных дисфункций все еще сохраняется при использовании таких химически модифицированных продуктов гемоглобина (87). Такие продукты, как PHP, также указывают на такие риски сердечно-сосудистых и почечных дисфункций.
Важные примеры этого подхода можно найти в полиэтиленгликолевой (ПЭГ) модификации Hb (например, продукты Hemospan от Sangart Inc, Сан-Диего, Калифорния, и PEG-Hb от Enzon, South Plainfield, NJ) и поли(оксиэтиленовой) модификации Hb. пиридоксилированный сшитый Hb (например, продукт PHP от Apex Bioscience, Durham, NC). ПЭГ-илированные продукты гемоглобина прошли обширные клинические испытания, и исследования показали риск брадикардии и повышения активности печеночных ферментов поджелудочной железы даже при низких дозах (86).Тем не менее, клинические испытания Фазы I и Фазы II показали, что Гемоспан хорошо переносится людьми для эффективной доставки кислорода, а испытания Фазы III у пациентов ортопедической хирургии проводились в Европе. Испытания показали, что риск сердечно-сосудистых и почечных дисфункций все еще сохраняется при использовании таких химически модифицированных продуктов гемоглобина (87). Такие продукты, как PHP, также указывают на такие риски сердечно-сосудистых и почечных дисфункций. За последние два десятилетия было установлено, что бесклеточный гемоглобин (включая химически модифицированные версии) является мощным поглотителем оксида азота (NO) посредством быстрого необратимого связывания (константа скорости ~ 10 7 М -1 с -1 ), что, в свою очередь, может влиять на тонус системных и легочных сосудов, приводя к вазоконстрикции, гипертензии и снижению сердечного выброса (88, 89).Была предпринята попытка решить эту проблему путем модификации молекулы гемоглобина с целью превращения ее в переносчика NO за счет S-нитрозилирования остатков цистеина в β-субъединицах гемоглобина или придания гемоглобину способности к ферментативному превращению в исходный донор NO в присутствии нитритов. , но пока с ограниченным успехом, in vivo (90). Естественные эритроциты содержат ферменты, такие как каталаза (CAT) и супероксиддисмутаза (SOD), которые помогают смягчить окислительный стресс, возникающий из-за супероксидных фрагментов в поврежденных и ишемизированных тканях.
За последние два десятилетия было установлено, что бесклеточный гемоглобин (включая химически модифицированные версии) является мощным поглотителем оксида азота (NO) посредством быстрого необратимого связывания (константа скорости ~ 10 7 М -1 с -1 ), что, в свою очередь, может влиять на тонус системных и легочных сосудов, приводя к вазоконстрикции, гипертензии и снижению сердечного выброса (88, 89).Была предпринята попытка решить эту проблему путем модификации молекулы гемоглобина с целью превращения ее в переносчика NO за счет S-нитрозилирования остатков цистеина в β-субъединицах гемоглобина или придания гемоглобину способности к ферментативному превращению в исходный донор NO в присутствии нитритов. , но пока с ограниченным успехом, in vivo (90). Естественные эритроциты содержат ферменты, такие как каталаза (CAT) и супероксиддисмутаза (SOD), которые помогают смягчить окислительный стресс, возникающий из-за супероксидных фрагментов в поврежденных и ишемизированных тканях. Основываясь на этом обосновании, в интересном подходе эти ферменты были сшиты с полимеризованным Hb с образованием PolyHb-SOD-CAT, что показало комбинированные преимущества длительного времени циркуляции и уменьшения окислительного повреждения (91, 92). Другим интересным подходом является включение регуляторных молекул, таких как 2,3-DPG и метгемоглобинредуктаза, вместе с гемоглобином в соответствующие системы HBOC для предотвращения окисления гемоглобина. В последние годы сообщалось о продукте под названием HemoTech, в котором используется очищенный бычий гемоглобин, поперечно связанный внутримолекулярно с АТФ и межмолекулярно с аденозином, а также конъюгированный с восстановленным глутатионом (GSH) (93).Этот уникальный дизайн позволяет использовать фармакологически активные молекулы (АТФ, аденозин и GSH) в качестве химических модификаторов, где АТФ регулирует тонус сосудов через пуринаргические рецепторы, аденозин противодействует вазоконстрикторным свойствам Hb посредством стимуляции аденозиновых рецепторов, а GSH защищает «гемовые рецепторы».
Основываясь на этом обосновании, в интересном подходе эти ферменты были сшиты с полимеризованным Hb с образованием PolyHb-SOD-CAT, что показало комбинированные преимущества длительного времени циркуляции и уменьшения окислительного повреждения (91, 92). Другим интересным подходом является включение регуляторных молекул, таких как 2,3-DPG и метгемоглобинредуктаза, вместе с гемоглобином в соответствующие системы HBOC для предотвращения окисления гемоглобина. В последние годы сообщалось о продукте под названием HemoTech, в котором используется очищенный бычий гемоглобин, поперечно связанный внутримолекулярно с АТФ и межмолекулярно с аденозином, а также конъюгированный с восстановленным глутатионом (GSH) (93).Этот уникальный дизайн позволяет использовать фармакологически активные молекулы (АТФ, аденозин и GSH) в качестве химических модификаторов, где АТФ регулирует тонус сосудов через пуринаргические рецепторы, аденозин противодействует вазоконстрикторным свойствам Hb посредством стимуляции аденозиновых рецепторов, а GSH защищает «гемовые рецепторы». ” из NO и различных активных форм кислорода. Доклинические и ранние клинические исследования показали, что HemoTech действует как эффективный переносчик кислорода при лечении кровопотери, анемии и ишемических сосудистых состояний, и необходимы дальнейшие исследования.Другим полимерным гемоглобином, о котором сообщалось в последние годы, является OxyVita, который производится путем модификации механизма полимеризации с нулевой связью с использованием химии карбодиимидов на бычьем тетрамерном гемоглобине для получения «суперполимерных» макромолекул (94). В еще одном недавнем подходе сообщалось о дизайне наноструктуры полинитроксилированного ПЭГ-илированного гемоглобина (PNPH), названного VitalHeme (SynZyme Technologies LLC, Ирвин, Калифорния), где ПЭГ-илированный гемоглобин ковалентно модифицирован каталитической клеткой NO (95).Сообщается, что эти конструкции обеспечивают более высокую стабильность гемоглобина in vivo и в настоящее время проходят доклинические исследования. показаны некоторые известные конструкции, основанные на химической модификации бесклеточного гемоглобина, которые прошли (или все еще проходят) доклинические и клинические испытания транспорта кислорода.
” из NO и различных активных форм кислорода. Доклинические и ранние клинические исследования показали, что HemoTech действует как эффективный переносчик кислорода при лечении кровопотери, анемии и ишемических сосудистых состояний, и необходимы дальнейшие исследования.Другим полимерным гемоглобином, о котором сообщалось в последние годы, является OxyVita, который производится путем модификации механизма полимеризации с нулевой связью с использованием химии карбодиимидов на бычьем тетрамерном гемоглобине для получения «суперполимерных» макромолекул (94). В еще одном недавнем подходе сообщалось о дизайне наноструктуры полинитроксилированного ПЭГ-илированного гемоглобина (PNPH), названного VitalHeme (SynZyme Technologies LLC, Ирвин, Калифорния), где ПЭГ-илированный гемоглобин ковалентно модифицирован каталитической клеткой NO (95).Сообщается, что эти конструкции обеспечивают более высокую стабильность гемоглобина in vivo и в настоящее время проходят доклинические исследования. показаны некоторые известные конструкции, основанные на химической модификации бесклеточного гемоглобина, которые прошли (или все еще проходят) доклинические и клинические испытания транспорта кислорода. Несмотря на многообещающие доклинические и клинические результаты, многие из химически модифицированных продуктов гемоглобина были отозваны из клинических исследований и прекращены в производстве из-за того, что у них больше клинических рисков, чем пользы, что связано с химической гетерогенностью и переменной стабильностью конечного продукта, субоптимальным временем пребывания в сосудах. , неидеальные возможности кислородной загрузки и разгрузки, быстрое необратимое преобразование в метгемоглобин и усиление проблем с сердечно-сосудистой и почечной дисфункцией.В то время как некоторые из более новых продуктов совершенствуют свой дизайн и обработку для решения этих проблем, параллельное направление исследований было сосредоточено на инкапсулировании гемоглобина в различные микро- и наноносители, чтобы более точно имитировать физиологическое инкапсулированное состояние гемоглобина в организме. эритроциты.
Несмотря на многообещающие доклинические и клинические результаты, многие из химически модифицированных продуктов гемоглобина были отозваны из клинических исследований и прекращены в производстве из-за того, что у них больше клинических рисков, чем пользы, что связано с химической гетерогенностью и переменной стабильностью конечного продукта, субоптимальным временем пребывания в сосудах. , неидеальные возможности кислородной загрузки и разгрузки, быстрое необратимое преобразование в метгемоглобин и усиление проблем с сердечно-сосудистой и почечной дисфункцией.В то время как некоторые из более новых продуктов совершенствуют свой дизайн и обработку для решения этих проблем, параллельное направление исследований было сосредоточено на инкапсулировании гемоглобина в различные микро- и наноносители, чтобы более точно имитировать физиологическое инкапсулированное состояние гемоглобина в организме. эритроциты.
 д.) гемоглобина, которые прошли значительную доклиническую и клиническую оценку.
д.) гемоглобина, которые прошли значительную доклиническую и клиническую оценку.Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
Инкапсулированные системы HBOC —
За последние два десятилетия технологии доставки лекарств в виде частиц (микрочастицы и наночастицы) произвели революцию в упаковке и доставке фармацевтических соединений путем их инкапсулирования внутри таких частиц, чтобы защитить их от эффектов, вызванных плазмой, увеличить их время циркуляции и обеспечивают постоянную доступность для клеток, тканей и органов. Эта концепция дизайна также была адаптирована для создания HBOC, которые инкапсулируют Hb в подходящие транспортные средства в виде твердых частиц.Фактически, новаторская концепция и демонстрация «биоискусственных клеток» была представлена еще в 1950-х и 1960-х годах Chang et al. путем инкапсуляции Hb, а также других белков и ферментов в микровезикулы на основе полимерных мембран. Первоначально в качестве мембранного материала использовался коллодий (нитрат целлюлозы), который позже был заменен на биоразлагаемый полиэтиленгликоль-полилактид (PEG-PLA) (96, 97). Эти наполненные гемоглобином микровезикулы, метко названные «гемоглобиновыми тельцами», демонстрируют кривые равновесия кислорода, сходные с эритроцитами, а также допускают коинкапсуляцию и активность ферментов, связанных с эритроцитами, таких как 2,3-дифосфоглицерат (2,3-ДФГ), карбоангидраза, и КПП (98–100).Однако в этих системах серьезной проблемой было быстрое поглощение макрофагами и выведение этих микрометровых везикул из кровотока, что приводило к субоптимальному времени пребывания в кровотоке для применения in vivo . Уменьшение диаметра до ~ 1 мкм лишь незначительно улучшило продолжительность циркуляции, и значительные исследовательские усилия были направлены на дальнейшее улучшение времени пребывания в сосудах путем модификации поверхности везикул липидами и полисахаридами. В другом подобном подходе к дизайну Djordjevich et al. сообщили об инкапсулировании Hb в липидные везикулы микронного и субмикронного размера (Hb, инкапсулированные в липосомы или LEH), с мембраной, состоящей из фосфолипидов и холестерина (101–103).
Эти наполненные гемоглобином микровезикулы, метко названные «гемоглобиновыми тельцами», демонстрируют кривые равновесия кислорода, сходные с эритроцитами, а также допускают коинкапсуляцию и активность ферментов, связанных с эритроцитами, таких как 2,3-дифосфоглицерат (2,3-ДФГ), карбоангидраза, и КПП (98–100).Однако в этих системах серьезной проблемой было быстрое поглощение макрофагами и выведение этих микрометровых везикул из кровотока, что приводило к субоптимальному времени пребывания в кровотоке для применения in vivo . Уменьшение диаметра до ~ 1 мкм лишь незначительно улучшило продолжительность циркуляции, и значительные исследовательские усилия были направлены на дальнейшее улучшение времени пребывания в сосудах путем модификации поверхности везикул липидами и полисахаридами. В другом подобном подходе к дизайну Djordjevich et al. сообщили об инкапсулировании Hb в липидные везикулы микронного и субмикронного размера (Hb, инкапсулированные в липосомы или LEH), с мембраной, состоящей из фосфолипидов и холестерина (101–103). Этот дизайн по существу имитирует физиологическое состояние Hb в эритроцитах, где он защищен липидной клеточной мембраной, которая сохраняет подходящие окислительно-восстановительные механизмы для функции Hb. Затем последовал ряд вариаций этого дизайна, например, «неогемоциты», «TRM-645 Neo Red Cells» и т. д., где основное внимание уделялось поддержанию одинаковых уровней инкапсуляции гемоглобина, равномерного распределения размеров везикул, минимизации везикул. дестабилизация или слияние с течением времени и повышают стабильность везикул при хранении, сохраняя при этом свойства транспорта кислорода, аналогичные эритроцитам, инкапсулированного гемоглобина (104–106).В 1990-х годах была клинически освоена технология «невидимых липосом», в которой липидные нановезикулы (диаметром 100–200 нм) функционализировались на поверхности полиэтиленгликолем (ПЭГ) для повышения стабильности при хранении, уменьшения опсонизации и предотвращения быстрого поглощения макрофагами. значительно увеличилось время пребывания в циркуляции (107, 108).
Этот дизайн по существу имитирует физиологическое состояние Hb в эритроцитах, где он защищен липидной клеточной мембраной, которая сохраняет подходящие окислительно-восстановительные механизмы для функции Hb. Затем последовал ряд вариаций этого дизайна, например, «неогемоциты», «TRM-645 Neo Red Cells» и т. д., где основное внимание уделялось поддержанию одинаковых уровней инкапсуляции гемоглобина, равномерного распределения размеров везикул, минимизации везикул. дестабилизация или слияние с течением времени и повышают стабильность везикул при хранении, сохраняя при этом свойства транспорта кислорода, аналогичные эритроцитам, инкапсулированного гемоглобина (104–106).В 1990-х годах была клинически освоена технология «невидимых липосом», в которой липидные нановезикулы (диаметром 100–200 нм) функционализировались на поверхности полиэтиленгликолем (ПЭГ) для повышения стабильности при хранении, уменьшения опсонизации и предотвращения быстрого поглощения макрофагами. значительно увеличилось время пребывания в циркуляции (107, 108). Следовательно, эта технология была адаптирована для формирования Hb-инкапсулированных PEG-илированных липосомальных везикул (HbV) (109–111). Для получения HbV в качестве основного мембранного фосфолипида использовали 1,2-диоктадекадиеноил-sn-глицеро-3-фосфатидилхолин (ДОДФХ), так что вызванный γ-облучением радиолиз молекул воды в везикулах генерировал гидроксильные (–ОН) радикалы, которые способствовал межмолекулярной полимеризации диеноильных групп с получением высокостабильных липосом, которые могли выдерживать процессы замораживания-оттаивания, сушки вымораживанием и регидратации.Дизайн HbV привел к значительному увеличению продолжительности кровообращения (~ 60 часов в некоторых животных моделях), и в последние годы сообщалось о нескольких усовершенствованиях этого дизайна (112–116). Было обнаружено, что кислородтранспортная способность HbV аналогична природным эритроцитам с сопоставимой кинетикой насыщения кислородом и высвобождения. Кроме того, липосомальная инкапсуляция гемоглобина предотвратила его эффект поглощения NO и, таким образом, уменьшила связанные с этим негативные эффекты на сосудистую сеть.
Следовательно, эта технология была адаптирована для формирования Hb-инкапсулированных PEG-илированных липосомальных везикул (HbV) (109–111). Для получения HbV в качестве основного мембранного фосфолипида использовали 1,2-диоктадекадиеноил-sn-глицеро-3-фосфатидилхолин (ДОДФХ), так что вызванный γ-облучением радиолиз молекул воды в везикулах генерировал гидроксильные (–ОН) радикалы, которые способствовал межмолекулярной полимеризации диеноильных групп с получением высокостабильных липосом, которые могли выдерживать процессы замораживания-оттаивания, сушки вымораживанием и регидратации.Дизайн HbV привел к значительному увеличению продолжительности кровообращения (~ 60 часов в некоторых животных моделях), и в последние годы сообщалось о нескольких усовершенствованиях этого дизайна (112–116). Было обнаружено, что кислородтранспортная способность HbV аналогична природным эритроцитам с сопоставимой кинетикой насыщения кислородом и высвобождения. Кроме того, липосомальная инкапсуляция гемоглобина предотвратила его эффект поглощения NO и, таким образом, уменьшила связанные с этим негативные эффекты на сосудистую сеть. Инкапсуляция гемоглобина в липосомальные везикулы также предотвращает гломерулярный клиренс гемоглобина (поскольку липосомы слишком велики для почечного клиренса) и, следовательно, снижает нефротоксичность.Текущий оптимизированный продукт HbV содержит около 30 000 молекул Hb, инкапсулированных в одной ПЭГ-илированной липосомальной везикуле диаметром ~ 250 нм. Для сравнения, естественный эритроцит имеет диаметр ~7 мкм и толщину ~2 мкм и содержит около 250 миллионов молекул гемоглобина. HbV прошли обширную доклиническую оценку на подходящих моделях животных для потенциального использования в качестве суррогата эритроцитов при переливании крови и реанимации для смягчения последствий массивного геморрагического шока и случаев гемодилюции, а также для оксигенации ишемизированных, а также трансплантированных тканей и органов.Эти исследования показали значительные перспективы использования HbV в качестве носителей кислорода, вдохновленных эритроцитами; тем не менее, эти системы все еще могут представлять проблемы широкого распределения размеров носителей, различий в эффективности инкапсуляции Hb, различной фармакокинетики и комплемент-опосредованного иммунного ответа in vivo .
Инкапсуляция гемоглобина в липосомальные везикулы также предотвращает гломерулярный клиренс гемоглобина (поскольку липосомы слишком велики для почечного клиренса) и, следовательно, снижает нефротоксичность.Текущий оптимизированный продукт HbV содержит около 30 000 молекул Hb, инкапсулированных в одной ПЭГ-илированной липосомальной везикуле диаметром ~ 250 нм. Для сравнения, естественный эритроцит имеет диаметр ~7 мкм и толщину ~2 мкм и содержит около 250 миллионов молекул гемоглобина. HbV прошли обширную доклиническую оценку на подходящих моделях животных для потенциального использования в качестве суррогата эритроцитов при переливании крови и реанимации для смягчения последствий массивного геморрагического шока и случаев гемодилюции, а также для оксигенации ишемизированных, а также трансплантированных тканей и органов.Эти исследования показали значительные перспективы использования HbV в качестве носителей кислорода, вдохновленных эритроцитами; тем не менее, эти системы все еще могут представлять проблемы широкого распределения размеров носителей, различий в эффективности инкапсуляции Hb, различной фармакокинетики и комплемент-опосредованного иммунного ответа in vivo . Дальнейшие исследования в настоящее время направлены на решение этих вопросов для возможного клинического применения дизайнов HbV, а также других аналогичных дизайнов систем гемоглобина, инкапсулированного в липосомы (LEH), заменителей эритроцитов (112–116).Интересно, что вместо инкапсуляции гемоглобина некоторые недавние исследовательские подходы также пытались инкапсулировать кислород (O 2 ) непосредственно в фосфолипидные микровезикулы (диаметром 2–4 мкм) для доставки O 2 в деоксигенированные эритроциты в кровотоке (117, 118). ). Хотя было обнаружено, что эти наполненные кислородом микропузырьки стабильны в течение нескольких недель при хранении с лишь небольшой степенью потери кислорода, in vivo они имеют очень короткое время жизни в циркуляции (<1 часа).Следовательно, лечение этими системами потребует многократных или повторных дозировок, что может привести к негативным последствиям нарушения регуляции окислительного стресса и связанной с ним токсичности и иммунного ответа.
Дальнейшие исследования в настоящее время направлены на решение этих вопросов для возможного клинического применения дизайнов HbV, а также других аналогичных дизайнов систем гемоглобина, инкапсулированного в липосомы (LEH), заменителей эритроцитов (112–116).Интересно, что вместо инкапсуляции гемоглобина некоторые недавние исследовательские подходы также пытались инкапсулировать кислород (O 2 ) непосредственно в фосфолипидные микровезикулы (диаметром 2–4 мкм) для доставки O 2 в деоксигенированные эритроциты в кровотоке (117, 118). ). Хотя было обнаружено, что эти наполненные кислородом микропузырьки стабильны в течение нескольких недель при хранении с лишь небольшой степенью потери кислорода, in vivo они имеют очень короткое время жизни в циркуляции (<1 часа).Следовательно, лечение этими системами потребует многократных или повторных дозировок, что может привести к негативным последствиям нарушения регуляции окислительного стресса и связанной с ним токсичности и иммунного ответа. Следовательно, необходимо тщательно оценить долгосрочный профиль безопасности таких технологий. Инкапсуляция Hb также изучалась в других системах микро- и наночастиц, помимо липидных везикул. В новаторской работе Chang et al. Hb был инкапсулирован в полимерные наночастицы (диаметром 80–200 нм), изготовленные из PEG-PLA и аналогичных блок-сополимеров (119, 120).Эти полимерные наночастицы могут обеспечить кинетику переноса кислорода для гемоглобина на уровне, аналогичном естественным эритроцитам, а полимерный материал может быть спроектирован так, чтобы быть биосовместимым и биоразлагаемым. Кроме того, ферменты, которые поддерживают окислительно-восстановительную среду для стабильности и регуляции функции гемоглобина (например, карбоангидраза, CAT, SOD, редуктаза MetHb и т. д.), также могут быть инкапсулированы в одни и те же наночастицы для дальнейшей имитации действия эритроцитов (121). Этот подход к проектированию также был принят для других полимерных систем, таких как сополимеры поли(ε-капролактон)/поли(L-молочная кислота) (PCL/PLA), поли(L-лизин) (PLL), поли(молочно-гликолевая кислота) кислота) сополимеры (PLGA)/PEG и т.
Следовательно, необходимо тщательно оценить долгосрочный профиль безопасности таких технологий. Инкапсуляция Hb также изучалась в других системах микро- и наночастиц, помимо липидных везикул. В новаторской работе Chang et al. Hb был инкапсулирован в полимерные наночастицы (диаметром 80–200 нм), изготовленные из PEG-PLA и аналогичных блок-сополимеров (119, 120).Эти полимерные наночастицы могут обеспечить кинетику переноса кислорода для гемоглобина на уровне, аналогичном естественным эритроцитам, а полимерный материал может быть спроектирован так, чтобы быть биосовместимым и биоразлагаемым. Кроме того, ферменты, которые поддерживают окислительно-восстановительную среду для стабильности и регуляции функции гемоглобина (например, карбоангидраза, CAT, SOD, редуктаза MetHb и т. д.), также могут быть инкапсулированы в одни и те же наночастицы для дальнейшей имитации действия эритроцитов (121). Этот подход к проектированию также был принят для других полимерных систем, таких как сополимеры поли(ε-капролактон)/поли(L-молочная кислота) (PCL/PLA), поли(L-лизин) (PLL), поли(молочно-гликолевая кислота) кислота) сополимеры (PLGA)/PEG и т. д.(122, 123). Амфифильные блок-сополимерные системы также обеспечивают идеальные строительные блоки для создания полимерных везикул, также известных как полимерсомы, аналогичные липосомам. Эти полимерсомные системы недавно были использованы для создания инкапсулированных в полимеросомы систем Hb (PEH) (124). Сообщается, что нагрузка Hb в этих системах PEH составляет от 1 до 2 мг/мл -1 , по сравнению с концентрацией в крови человека (т.е. в эритроцитах) ~ 150 мг мл -1 . Использование системы экструзии мембран на основе полых волокон предоставило интересный способ производства этих систем PEH (125).Сообщалось, что эти системы PEH способны инкапсулировать как бычий, так и человеческий гемоглобин, и демонстрируют кинетику кислородного равновесия и другие биофизические параметры, сходные с эритроцитами. Это указывает на значительные перспективы применения таких систем PEH в качестве суррогатов эритроцитов в трансфузионной медицине, но в настоящее время для этих систем доступны очень ограниченные данные оценки in vivo .
д.(122, 123). Амфифильные блок-сополимерные системы также обеспечивают идеальные строительные блоки для создания полимерных везикул, также известных как полимерсомы, аналогичные липосомам. Эти полимерсомные системы недавно были использованы для создания инкапсулированных в полимеросомы систем Hb (PEH) (124). Сообщается, что нагрузка Hb в этих системах PEH составляет от 1 до 2 мг/мл -1 , по сравнению с концентрацией в крови человека (т.е. в эритроцитах) ~ 150 мг мл -1 . Использование системы экструзии мембран на основе полых волокон предоставило интересный способ производства этих систем PEH (125).Сообщалось, что эти системы PEH способны инкапсулировать как бычий, так и человеческий гемоглобин, и демонстрируют кинетику кислородного равновесия и другие биофизические параметры, сходные с эритроцитами. Это указывает на значительные перспективы применения таких систем PEH в качестве суррогатов эритроцитов в трансфузионной медицине, но в настоящее время для этих систем доступны очень ограниченные данные оценки in vivo . Потенциальной проблемой полимерсомных систем может быть их более высокая толщина оболочки по сравнению с липосомами, что может привести к более длительному времени диффузии кислорода для насыщения инкапсулированного гемоглобина или его высвобождения из гемоглобина в ткани.Модуляция молекулярной массы полимера оболочки и, следовательно, толщины оболочки может обеспечить уникальный способ воздействия на свойства переноса кислорода системами PEH. Более высокая стабильность полимерсом по сравнению с липосомами как при хранении, так и in vivo также может обеспечить дополнительные преимущества для их использования в качестве суррогатных систем эритроцитов, инкапсулированных Hb. Текущие и будущие исследования с этими системами должны быть направлены на установление согласованности между партиями, оценку показателей стерилизации и стабильности при хранении, определение биоактивности гемоглобина после стерилизации, определение in vivo фармакокинетики и биораспределения , а также терапевтическую оценку на соответствующих моделях животных.
Потенциальной проблемой полимерсомных систем может быть их более высокая толщина оболочки по сравнению с липосомами, что может привести к более длительному времени диффузии кислорода для насыщения инкапсулированного гемоглобина или его высвобождения из гемоглобина в ткани.Модуляция молекулярной массы полимера оболочки и, следовательно, толщины оболочки может обеспечить уникальный способ воздействия на свойства переноса кислорода системами PEH. Более высокая стабильность полимерсом по сравнению с липосомами как при хранении, так и in vivo также может обеспечить дополнительные преимущества для их использования в качестве суррогатных систем эритроцитов, инкапсулированных Hb. Текущие и будущие исследования с этими системами должны быть направлены на установление согласованности между партиями, оценку показателей стерилизации и стабильности при хранении, определение биоактивности гемоглобина после стерилизации, определение in vivo фармакокинетики и биораспределения , а также терапевтическую оценку на соответствующих моделях животных. (т.е.г., геморрагический шок, ишемия и др.). показаны некоторые репрезентативные конструкции и компоненты инкапсулированных систем гемоглобина, которые прошли и в настоящее время проходят испытания in vitro и in vivo для применения в качестве носителей кислорода, имитирующих эритроциты.
(т.е.г., геморрагический шок, ишемия и др.). показаны некоторые репрезентативные конструкции и компоненты инкапсулированных систем гемоглобина, которые прошли и в настоящее время проходят испытания in vitro и in vivo для применения в качестве носителей кислорода, имитирующих эритроциты.
Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
Новые молекулы и конструкции, включающие Hb в виде O
2 носитель — В этом разделе не проводится различие между «химически модифицированными» и «инкапсулированными» системами Hb, а основное внимание уделяется обзору некоторых новых новых конструкций и технологий, включающих Hb для транспорта кислорода. В одном интересном подходе вместо гемоглобина проводилось ПЭГ-илирование бычьего карбоксигемоглобина (CO-Hb), и получающаяся в результате система ПЭГ-СО-Hb оценивалась на свойства транспорта кислорода (и транспорта СО) (126–128). Обоснование этого дизайна заключается в том, что, как сообщается, эндогенный CO, продуцируемый активностью гемооксигеназы, может оказывать цитопротекторное и гомеостатическое действие, такое как ингибирование апоптоза и воспаления, а также снижение окислительного стресса и сосудорасширяющей активности (129). Продукт PEG-CO-Hb под коммерческим названием SAN-GUINATE (Prolong Pharmaceuticals, Саут-Плейнфилд, Нью-Джерси, США) прошел доклиническую оценку на моделях мелких животных и проходит клинические испытания при лечении небольших групп пациентов. в области серповидно-клеточной анемии, тромботической тромбоцитопенической пурпуры (ТТП) и ишемии после субарахноидального кровоизлияния, с многообещающим профилем безопасности и параметрами оксигенации.В другом недавнем подходе кластерные структуры сердцевина-оболочка были сформированы путем конъюгации человеческого сывороточного альбумина (HSA) с Hb с использованием поверхностных лизинов Hb, конъюгированных с HSA цистеином-34, с использованием α-сукцинимидил-ε-малеимидного сшивающего агента (130).
Обоснование этого дизайна заключается в том, что, как сообщается, эндогенный CO, продуцируемый активностью гемооксигеназы, может оказывать цитопротекторное и гомеостатическое действие, такое как ингибирование апоптоза и воспаления, а также снижение окислительного стресса и сосудорасширяющей активности (129). Продукт PEG-CO-Hb под коммерческим названием SAN-GUINATE (Prolong Pharmaceuticals, Саут-Плейнфилд, Нью-Джерси, США) прошел доклиническую оценку на моделях мелких животных и проходит клинические испытания при лечении небольших групп пациентов. в области серповидно-клеточной анемии, тромботической тромбоцитопенической пурпуры (ТТП) и ишемии после субарахноидального кровоизлияния, с многообещающим профилем безопасности и параметрами оксигенации.В другом недавнем подходе кластерные структуры сердцевина-оболочка были сформированы путем конъюгации человеческого сывороточного альбумина (HSA) с Hb с использованием поверхностных лизинов Hb, конъюгированных с HSA цистеином-34, с использованием α-сукцинимидил-ε-малеимидного сшивающего агента (130).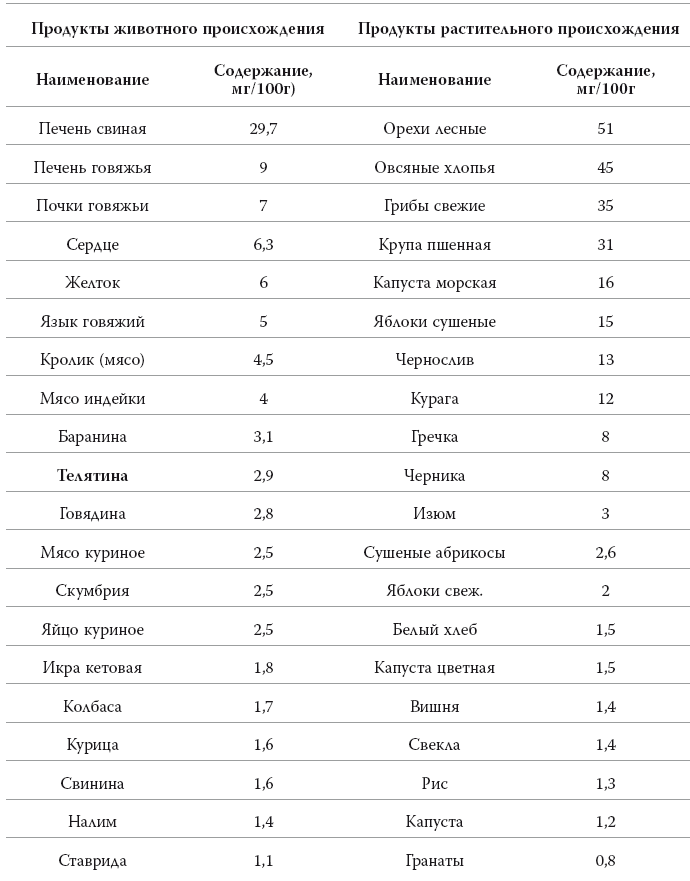 Сообщается, что эти кластеры Hb-HSA снижают риск быстрого клиренса и экстравазации и, таким образом, улучшают высокую стабильность циркуляции и время пребывания. Недавно сообщалось о дальнейшей модификации этих нанокластеров ядро-оболочка Hb-HSA, когда антиоксидантные ферменты и наночастицы платины были встроены в карманы HSA для защиты Hb (131).Эти конструкции нанокластеров до сих пор были оценены только in vitro на их способность связывать кислород, окислительно-восстановительные свойства и стабильность, что дало многообещающие результаты. Однако для установления применимости этих структур in vivo для применения этих структур необходимы тщательные исследования фармакокинетики in vivo, токсикологии, бираспределения и оксигенации, а также демонстрация композиционной и функциональной согласованности от партии к партии. В другом подходе Hb загружали в микрочастицы путем его соосаждения с карбонатом кальция (CaCO 3 ), с последующим сшиванием глутаровым альдегидом и селективным растворением CaCO 3 , в результате чего количество Hb на микрочастицу было близко к количеству естественных эритроцитов ( 132).
Сообщается, что эти кластеры Hb-HSA снижают риск быстрого клиренса и экстравазации и, таким образом, улучшают высокую стабильность циркуляции и время пребывания. Недавно сообщалось о дальнейшей модификации этих нанокластеров ядро-оболочка Hb-HSA, когда антиоксидантные ферменты и наночастицы платины были встроены в карманы HSA для защиты Hb (131).Эти конструкции нанокластеров до сих пор были оценены только in vitro на их способность связывать кислород, окислительно-восстановительные свойства и стабильность, что дало многообещающие результаты. Однако для установления применимости этих структур in vivo для применения этих структур необходимы тщательные исследования фармакокинетики in vivo, токсикологии, бираспределения и оксигенации, а также демонстрация композиционной и функциональной согласованности от партии к партии. В другом подходе Hb загружали в микрочастицы путем его соосаждения с карбонатом кальция (CaCO 3 ), с последующим сшиванием глутаровым альдегидом и селективным растворением CaCO 3 , в результате чего количество Hb на микрочастицу было близко к количеству естественных эритроцитов ( 132). Эти микрочастицы гемоглобина показали кинетику кислородного равновесия, аналогичную кинетике свободного гемоглобина, но гораздо более продолжительное время циркуляции по сравнению со свободным гемоглобином. Сообщалось об аналогичных микрочастицах Hb, содержащих около 80% Hb по сравнению с природными эритроцитами, где Hb и MnCO 3 были соосаждены, после чего сразу же добавляли человеческий сывороточный альбумин для инкапсуляции и стабилизации частиц (133). Эти частицы показали сниженный риск поглощения NO и связанный с этим эффект на вазоконстрикцию.В еще одном недавнем подходе гемоглобин был ковалентно конъюгирован непосредственно с гидрофобным или гидрофильным доменом блок-сополимеров, и полученные конъюгаты самособирались с образованием мицелл, нагруженных гемоглобином (134, 135). В другом интересном дизайне наночастицы MnCO 3 использовались в качестве шаблонов для послойного осаждения (LBL) сборок гемоглобина и диальдегидгепарина (DHP) с последующим сшиванием для стабилизации слоев и селективного растворения ядра шаблона (136).
Эти микрочастицы гемоглобина показали кинетику кислородного равновесия, аналогичную кинетике свободного гемоглобина, но гораздо более продолжительное время циркуляции по сравнению со свободным гемоглобином. Сообщалось об аналогичных микрочастицах Hb, содержащих около 80% Hb по сравнению с природными эритроцитами, где Hb и MnCO 3 были соосаждены, после чего сразу же добавляли человеческий сывороточный альбумин для инкапсуляции и стабилизации частиц (133). Эти частицы показали сниженный риск поглощения NO и связанный с этим эффект на вазоконстрикцию.В еще одном недавнем подходе гемоглобин был ковалентно конъюгирован непосредственно с гидрофобным или гидрофильным доменом блок-сополимеров, и полученные конъюгаты самособирались с образованием мицелл, нагруженных гемоглобином (134, 135). В другом интересном дизайне наночастицы MnCO 3 использовались в качестве шаблонов для послойного осаждения (LBL) сборок гемоглобина и диальдегидгепарина (DHP) с последующим сшиванием для стабилизации слоев и селективного растворения ядра шаблона (136).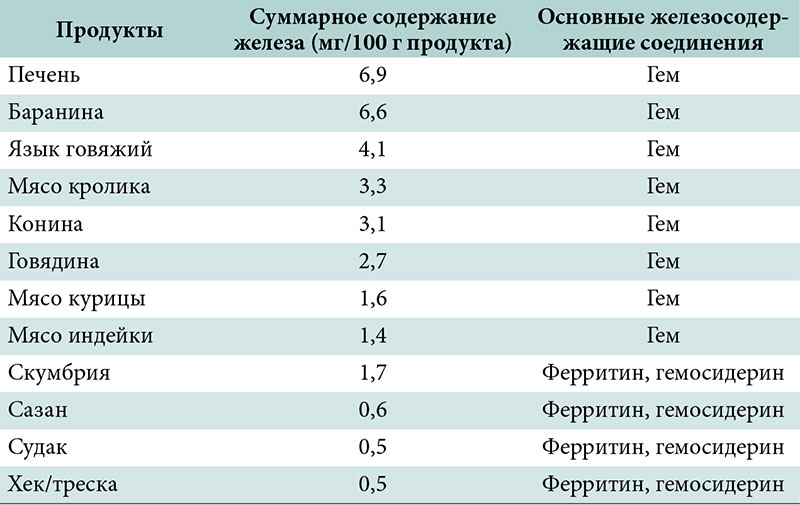 ). Подобный подход также использовался для формирования нанотрубок, покрытых L-B-L, где были нанесены чередующиеся слои Hb, DHP и фермента CAT, чтобы создать системы для потенциального применения при лечении окислительного стресса (137).Эти сложные наноструктуры были охарактеризованы in vitro на предмет их морфологии, стабильности, цитотоксичности и, в некоторых случаях, биофункциональности, но о доклинической оценке эффективности переноса кислорода in vivo еще не сообщалось. Еще одним недавним интересным достижением в области новых молекул HBOC является использование внеклеточного гемоглобина с большой молекулярной массой, выделенного из морских беспозвоночных, таких как полихеты кольчатых червей (например, продукт HEMOXYCarrier от Hemarina, Morlaix, France) (138).Доклинические исследования этой уникальной молекулы гемоглобина показали снижение сужения сосудов микроциркуляторного русла и отсутствие значительного влияния на среднее артериальное давление по сравнению с другими HBOC, в которых используется гемоглобин крупного рогатого скота или человека (139).
). Подобный подход также использовался для формирования нанотрубок, покрытых L-B-L, где были нанесены чередующиеся слои Hb, DHP и фермента CAT, чтобы создать системы для потенциального применения при лечении окислительного стресса (137).Эти сложные наноструктуры были охарактеризованы in vitro на предмет их морфологии, стабильности, цитотоксичности и, в некоторых случаях, биофункциональности, но о доклинической оценке эффективности переноса кислорода in vivo еще не сообщалось. Еще одним недавним интересным достижением в области новых молекул HBOC является использование внеклеточного гемоглобина с большой молекулярной массой, выделенного из морских беспозвоночных, таких как полихеты кольчатых червей (например, продукт HEMOXYCarrier от Hemarina, Morlaix, France) (138).Доклинические исследования этой уникальной молекулы гемоглобина показали снижение сужения сосудов микроциркуляторного русла и отсутствие значительного влияния на среднее артериальное давление по сравнению с другими HBOC, в которых используется гемоглобин крупного рогатого скота или человека (139). В настоящее время продолжаются дальнейшие исследования этой системы для установления ее клинического потенциала в качестве терапевтического переносчика кислорода.
В настоящее время продолжаются дальнейшие исследования этой системы для установления ее клинического потенциала в качестве терапевтического переносчика кислорода.
В последние годы некоторые подходы к инкапсуляции гемоглобина также были направлены на адаптацию физико-механических свойств естественных эритроцитов, которые значительно влияют на их биологические функции.Естественные здоровые эритроциты имеют двояковогнутую дисковидную морфологию диаметром ~ 8 мкм и толщиной ~ 2 мкм. Эти эритроциты также обладают высокой гибкостью (модуль Юнга 0,1–0,2 кПа), что позволяет им изменять свою морфологию при прохождении через микроциркуляторное русло (140, 141). Механическая целостность и вязкоупругий характер эритроцитов во время их циклической деформации обеспечиваются двумерной спектриновой сетью, прикрепленной к цитозольной стороне их мембраны. Оксигенированный гемоглобин приводит к тому, что эритроциты обладают значительно большей деформируемостью, чем дезоксигенированный гемоглобин, и это позволяет механически гибким эритроцитам перемещаться по микроциркуляторному руслу для транспортировки кислорода. Размер, форма и гибкость эритроцитов также влияют на их движение и распределение в поле кровотока, где они в основном находятся в центре поля параболического потока в средних и крупных сосудах, в то время как в мелких сосудах и капиллярах эритроциты могут распределяться по всему телу. для эффективного обмена кислорода (142). Эти соображения недавно привели к имитации размера, формы и гибкости эритроцитов на основе биоматериалов в синтетических конструкциях, инкапсулирующих гемоглобин. Например, послойная сборка полиэлектролита использовалась для создания микрочастиц, имитирующих форму и деформируемость естественных эритроцитов (143).В этом подходе Hb и BSA электростатически осаждались на поверхности дискоидных частиц PLGA диаметром ~ 7 мкм и толщиной оболочки 400 нм, а затем ядро PLGA селективно растворялось с получением эритроцитарных частиц, загруженных Hb, которые имеют высокую упругую деформацию. . Подобные гибкие частицы, имитирующие эритроциты, были изготовлены с использованием гидрогелевой системы PEG в подходе литографии с остановкой потока (SFL), где механические свойства полученных частиц можно было контролировать, модулируя плотность сшивания гидрогелевых систем (144).
Размер, форма и гибкость эритроцитов также влияют на их движение и распределение в поле кровотока, где они в основном находятся в центре поля параболического потока в средних и крупных сосудах, в то время как в мелких сосудах и капиллярах эритроциты могут распределяться по всему телу. для эффективного обмена кислорода (142). Эти соображения недавно привели к имитации размера, формы и гибкости эритроцитов на основе биоматериалов в синтетических конструкциях, инкапсулирующих гемоглобин. Например, послойная сборка полиэлектролита использовалась для создания микрочастиц, имитирующих форму и деформируемость естественных эритроцитов (143).В этом подходе Hb и BSA электростатически осаждались на поверхности дискоидных частиц PLGA диаметром ~ 7 мкм и толщиной оболочки 400 нм, а затем ядро PLGA селективно растворялось с получением эритроцитарных частиц, загруженных Hb, которые имеют высокую упругую деформацию. . Подобные гибкие частицы, имитирующие эритроциты, были изготовлены с использованием гидрогелевой системы PEG в подходе литографии с остановкой потока (SFL), где механические свойства полученных частиц можно было контролировать, модулируя плотность сшивания гидрогелевых систем (144). В другом подходе частицы, имитирующие форму эритроцитов, были изготовлены из акрилатных гидрогелей с использованием технологии «репликации частиц в несмачивающих шаблонах» (PRINT) (145). Эти частицы были изготовлены в формах размером от 2 до 3 мкм, так что при гидратации частицы набухали в диски диаметром примерно 6 мкм и высотой примерно 1,5 мкм. Кроме того, эффект мениска форм приводит к тому, что частицы становятся тоньше в середине и утолщаются по краям, что напоминает двояковогнутую морфологию эритроцитов.Морфология и гибкость эритроцитов, имитирующие конструкции частиц, полученные с помощью этих двух методов, продемонстрировали способность к упругой деформации in vitro для транспорта через узкие каналы и контролируемое время жизни циркуляции in vivo в зависимости от их модуля упругости. Хотя сообщалось, что эти частицы способны к инкапсуляции гемоглобина посредством физического захвата или ковалентного связывания, подробные сведения о возможностях транспорта кислорода и связанных с ними применениях для переливания in vivo еще не сообщались.
В другом подходе частицы, имитирующие форму эритроцитов, были изготовлены из акрилатных гидрогелей с использованием технологии «репликации частиц в несмачивающих шаблонах» (PRINT) (145). Эти частицы были изготовлены в формах размером от 2 до 3 мкм, так что при гидратации частицы набухали в диски диаметром примерно 6 мкм и высотой примерно 1,5 мкм. Кроме того, эффект мениска форм приводит к тому, что частицы становятся тоньше в середине и утолщаются по краям, что напоминает двояковогнутую морфологию эритроцитов.Морфология и гибкость эритроцитов, имитирующие конструкции частиц, полученные с помощью этих двух методов, продемонстрировали способность к упругой деформации in vitro для транспорта через узкие каналы и контролируемое время жизни циркуляции in vivo в зависимости от их модуля упругости. Хотя сообщалось, что эти частицы способны к инкапсуляции гемоглобина посредством физического захвата или ковалентного связывания, подробные сведения о возможностях транспорта кислорода и связанных с ними применениях для переливания in vivo еще не сообщались. В другом интересном подходе конструкции актин-гемоглобин, инкапсулированные в липосомы (LEAcHb), были получены с использованием полимеризованного актинового ядра, чтобы имитировать морфологию естественных эритроцитов (146). Хотя эти частицы были намного меньше (~ 136,8 нм), чем эритроциты, двояковогнутая форма вместе с механической опорой мембраны увеличила период полураспада до ~ 72 часов. В естественных эритроцитах отрицательный поверхностный заряд электростатически предотвращает агрегацию эритроцитов на расстоянии 20 нм, и это обоснование привело к некоторым исследованиям по имитации поверхностного заряда, относящегося к эритроцитам, на инкапсулированных гемоглобином наночастицах PEG-PLA (<200 нм в диаметре) с использованием цетилтриметиламмония. бромидные (CTAB) или анионные додецилсульфат натрия (SDS) поверхностно-активные вещества (147).Было обнаружено, что период полураспада катионизированных частиц составляет ~11 часов (в 8 раз больше, чем у необработанных частиц), в то время как анионизированные частицы быстро удаляются, что дает период полураспада <1 часа.
В другом интересном подходе конструкции актин-гемоглобин, инкапсулированные в липосомы (LEAcHb), были получены с использованием полимеризованного актинового ядра, чтобы имитировать морфологию естественных эритроцитов (146). Хотя эти частицы были намного меньше (~ 136,8 нм), чем эритроциты, двояковогнутая форма вместе с механической опорой мембраны увеличила период полураспада до ~ 72 часов. В естественных эритроцитах отрицательный поверхностный заряд электростатически предотвращает агрегацию эритроцитов на расстоянии 20 нм, и это обоснование привело к некоторым исследованиям по имитации поверхностного заряда, относящегося к эритроцитам, на инкапсулированных гемоглобином наночастицах PEG-PLA (<200 нм в диаметре) с использованием цетилтриметиламмония. бромидные (CTAB) или анионные додецилсульфат натрия (SDS) поверхностно-активные вещества (147).Было обнаружено, что период полураспада катионизированных частиц составляет ~11 часов (в 8 раз больше, чем у необработанных частиц), в то время как анионизированные частицы быстро удаляются, что дает период полураспада <1 часа. В еще одном недавнем подходе была разработана новая амфифильная полимерная система с использованием полиэтиленимина (ПЭИ), модифицированного пальмитиновой кислотой, и использовалась для формирования наночастиц тороидальной формы (называемых нанобиалисом, диаметром ~ 200 нм), которые могут инкапсулировать гемоглобин, а также поддерживать окислительно-восстановительная ферментативная среда для активности гемоглобина путем совместной инкапсуляции 2,3-ДФГ и лейкометиленового синего (148).Эти новые Hb-содержащие частицы, называемые эритромерами, продемонстрировали некоторые перспективы переноса кислорода in vivo . Детальные исследования биосовместимости (например, для PEI, которые могут создавать проблемы с цитотоксичностью), продолжительность жизни и стабильность циркуляции, способность Hb-нагрузки и возможности транспорта кислорода и т. д. потребуют дальнейшей оценки для установления клинического потенциала таких дизайнов в качестве суррогатов эритроцитов при переливании. лекарство.
В еще одном недавнем подходе была разработана новая амфифильная полимерная система с использованием полиэтиленимина (ПЭИ), модифицированного пальмитиновой кислотой, и использовалась для формирования наночастиц тороидальной формы (называемых нанобиалисом, диаметром ~ 200 нм), которые могут инкапсулировать гемоглобин, а также поддерживать окислительно-восстановительная ферментативная среда для активности гемоглобина путем совместной инкапсуляции 2,3-ДФГ и лейкометиленового синего (148).Эти новые Hb-содержащие частицы, называемые эритромерами, продемонстрировали некоторые перспективы переноса кислорода in vivo . Детальные исследования биосовместимости (например, для PEI, которые могут создавать проблемы с цитотоксичностью), продолжительность жизни и стабильность циркуляции, способность Hb-нагрузки и возможности транспорта кислорода и т. д. потребуют дальнейшей оценки для установления клинического потенциала таких дизайнов в качестве суррогатов эритроцитов при переливании. лекарство. показаны схемы этих новых появляющихся конструкций и структур переносчиков кислорода на основе гемоглобина.
показаны схемы этих новых появляющихся конструкций и структур переносчиков кислорода на основе гемоглобина.
Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
СОВРЕМЕННОЕ СОСТОЯНИЕ И НОВЫЕ МОЛЕКУЛЫ
В суровых условиях поля боя и в отдаленных районах неконтролируемое кровотечение, связанное с травмой, и острая коагулопатия остаются одной из основных причин смертности (1–6).В таких сценариях переливание цельной крови и компонентов крови (например, эритроцитов, тромбоцитов и плазмы) в соответствии с рекомендациями по реанимации с контролем повреждений может значительно снизить заболеваемость и смертность, связанные с травмами (7–9). Однако ограниченная доступность и портативность, особые требования к хранению и высокий риск контаминации этих продуктов крови часто создают серьезные логистические проблемы для их догоспитального применения в военных и гражданских сценариях, для немедленного и длительного лечения в месте повреждения (т.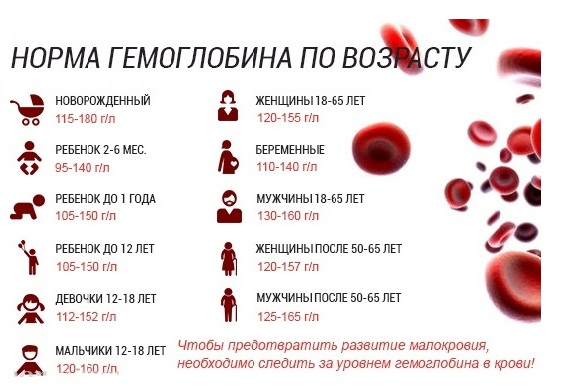 г., в пути) полевой уход (10–17). В настоящее время проводится большой объем исследований, направленных на решение этих проблем и повышение доступности и применимости продуктов донорской крови в полевых условиях (18–21). Параллельно с этим возникла захватывающая область исследований, которая сосредоточена на разработке и оценке полусинтетических или синтетических заменителей продуктов крови, которые можно производить в больших масштабах in vitro (т. е. при достаточной доступности), можно стерилизовать и хранить в небольших объемах. в течение длительных периодов времени при различных температурных диапазонах (т.д., легкая переносимость), могут быть восстановлены и введены «по требованию» в далеко зашедших сценариях (т. е. догоспитальная применимость), могут потенциально избежать необходимости сопоставления типов (универсальное применение с минимальным иммуногенным риском), могут безопасно циркулировать при внутрисосудистом введении без системных рисков и может имитировать, усиливать и усиливать эндогенные механизмы функционирования компонентов крови для смягчения последствий травматического обескровливающего кровотечения (22–24).
г., в пути) полевой уход (10–17). В настоящее время проводится большой объем исследований, направленных на решение этих проблем и повышение доступности и применимости продуктов донорской крови в полевых условиях (18–21). Параллельно с этим возникла захватывающая область исследований, которая сосредоточена на разработке и оценке полусинтетических или синтетических заменителей продуктов крови, которые можно производить в больших масштабах in vitro (т. е. при достаточной доступности), можно стерилизовать и хранить в небольших объемах. в течение длительных периодов времени при различных температурных диапазонах (т.д., легкая переносимость), могут быть восстановлены и введены «по требованию» в далеко зашедших сценариях (т. е. догоспитальная применимость), могут потенциально избежать необходимости сопоставления типов (универсальное применение с минимальным иммуногенным риском), могут безопасно циркулировать при внутрисосудистом введении без системных рисков и может имитировать, усиливать и усиливать эндогенные механизмы функционирования компонентов крови для смягчения последствий травматического обескровливающего кровотечения (22–24).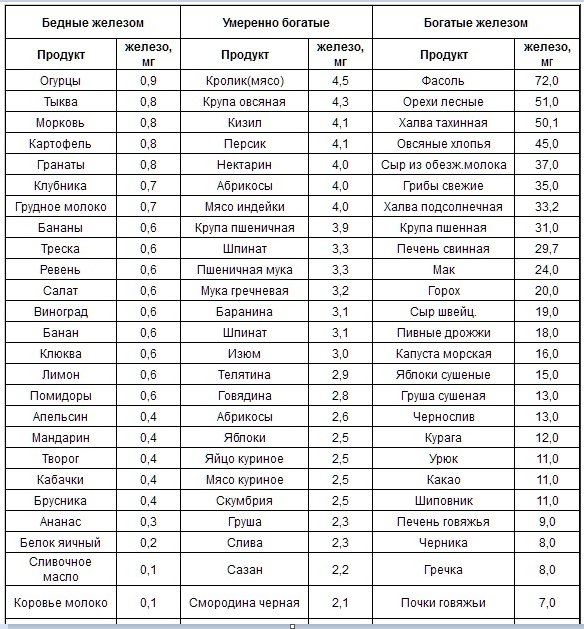 Эта область исследований развивалась в области функциональной имитации клеточных, а также неклеточных компонентов крови и по-прежнему сосредоточена на решении трансляционных задач в отношении биосовместимости, безопасности, догоспитальной доступности и универсальности.
Эта область исследований развивалась в области функциональной имитации клеточных, а также неклеточных компонентов крови и по-прежнему сосредоточена на решении трансляционных задач в отношении биосовместимости, безопасности, догоспитальной доступности и универсальности.
Исследования по сохранению и транспортировке донорской крови начались во время Первой мировой войны для лечения раненых солдат, а переливание крови стало широко доступным во время Второй мировой войны. С 1950-х годов в Соединенных Штатах было создано несколько банков крови, и донорство крови пропагандировалось как форма гражданской ответственности. Последующая разработка процессов и методологий выделения и хранения различных компонентов крови значительно расширила использование цельной крови и ее компонентов.В настоящее время переливание цельной крови, а также различных изолированных компонентов клинически одобрено для применения при травмах среди гражданского населения и на полях сражений (например, при реанимации с целью контроля повреждений), хирургических вмешательствах (например, при трансплантации), хронических и острых анемиях, а также связанных с заболеванием наркоманиях. индуцированные или врожденные нарушения свертываемости крови (25–32). Переливание эритроцитов имеет клиническое значение для эффективного смягчения геморрагического шока в рамках протокола массивной трансфузии у пациентов с гипоперфузией и критическими уровнями кислорода (33–37).Также было продемонстрировано, что переливание эритроцитарной массы на догоспитальном этапе (если возможно) может значительно улучшить выживаемость пациентов с критическими травмами (38, 39). Такие переливания зависят от продуктов донорских эритроцитов (например, эритроцитарной массы [pRBC]). Однако, по данным Красного Креста, только ~ 40% населения США имеют право сдавать кровь в любой момент времени, и только от 10% до 15% действительно сдают кровь. Кроме того, продукты на основе крови имеют несколько ограниченный срок хранения из-за риска патогенного заражения.В настоящее время срок годности эритроцитов составляет от 20 до 40 дней, тогда как срок хранения суспензий тромбоцитов составляет от 3 до 5 дней при комнатной температуре (40).
индуцированные или врожденные нарушения свертываемости крови (25–32). Переливание эритроцитов имеет клиническое значение для эффективного смягчения геморрагического шока в рамках протокола массивной трансфузии у пациентов с гипоперфузией и критическими уровнями кислорода (33–37).Также было продемонстрировано, что переливание эритроцитарной массы на догоспитальном этапе (если возможно) может значительно улучшить выживаемость пациентов с критическими травмами (38, 39). Такие переливания зависят от продуктов донорских эритроцитов (например, эритроцитарной массы [pRBC]). Однако, по данным Красного Креста, только ~ 40% населения США имеют право сдавать кровь в любой момент времени, и только от 10% до 15% действительно сдают кровь. Кроме того, продукты на основе крови имеют несколько ограниченный срок хранения из-за риска патогенного заражения.В настоящее время срок годности эритроцитов составляет от 20 до 40 дней, тогда как срок хранения суспензий тромбоцитов составляет от 3 до 5 дней при комнатной температуре (40). Кроме того, в эритроцитах (и тромбоцитах) при хранении развиваются повреждения, которые влияют на их стабильность, продолжительность циркуляции in vivo и биоактивные функции (41, 42). Проводятся значительные исследования по увеличению срока годности продуктов крови путем хранения в холодильнике, замораживания, лиофилизации и т. д., а также путем разработки технологий снижения патогенности, таких как ультрафиолетовое облучение на основе псоралена или рибофлавина, обширные серологические исследования. тестирование донорской крови, лейкоредукция и специальные протоколы хранения (13, 19, 31, 43–48).Кроме того, транспортировка продуктов крови, особенно на удаленные поля боевых действий и в гражданские районы, особенно для догоспитального использования в пунктах оказания медицинской помощи, продолжает оставаться серьезной логистической проблемой (14, 17, 49).
Кроме того, в эритроцитах (и тромбоцитах) при хранении развиваются повреждения, которые влияют на их стабильность, продолжительность циркуляции in vivo и биоактивные функции (41, 42). Проводятся значительные исследования по увеличению срока годности продуктов крови путем хранения в холодильнике, замораживания, лиофилизации и т. д., а также путем разработки технологий снижения патогенности, таких как ультрафиолетовое облучение на основе псоралена или рибофлавина, обширные серологические исследования. тестирование донорской крови, лейкоредукция и специальные протоколы хранения (13, 19, 31, 43–48).Кроме того, транспортировка продуктов крови, особенно на удаленные поля боевых действий и в гражданские районы, особенно для догоспитального использования в пунктах оказания медицинской помощи, продолжает оставаться серьезной логистической проблемой (14, 17, 49).
Такие проблемы потенциально могут быть решены путем разработки полусинтетических или синтетических заменителей компонентов крови (22, 50, 51). На самом деле, интерес к таким синтетическим заменителям возник во время кризиса ВИЧ 1980-х годов из-за страха перед зараженными продуктами крови (4), и это исследование продолжалось в течение последних нескольких десятилетий, с несколькими разработками и продуктами, которые прошли доклинические и клинические оценки.Однако в настоящее время ни один такой продукт не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для применения человеком в Соединенных Штатах, хотя некоторые продукты были одобрены для использования человеком в Южной Африке и в ветеринарии в Соединенных Штатах. Метаанализ 2008 г. 16 клинических испытаний пяти различных заменителей эритроцитов показал повышенный риск для здоровья у пациентов, получавших такие продукты (52). Несмотря на то, что такой анализ привел к некоторым опасениям в отношении клинической безопасности и полезности этих продуктов, дизайн этого анализа активно обсуждался, и он также направил значительный новый акцент на понимание плюсов и минусов этих продуктов на фундаментальном физиологическом и механистическом уровнях.
На самом деле, интерес к таким синтетическим заменителям возник во время кризиса ВИЧ 1980-х годов из-за страха перед зараженными продуктами крови (4), и это исследование продолжалось в течение последних нескольких десятилетий, с несколькими разработками и продуктами, которые прошли доклинические и клинические оценки.Однако в настоящее время ни один такой продукт не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для применения человеком в Соединенных Штатах, хотя некоторые продукты были одобрены для использования человеком в Южной Африке и в ветеринарии в Соединенных Штатах. Метаанализ 2008 г. 16 клинических испытаний пяти различных заменителей эритроцитов показал повышенный риск для здоровья у пациентов, получавших такие продукты (52). Несмотря на то, что такой анализ привел к некоторым опасениям в отношении клинической безопасности и полезности этих продуктов, дизайн этого анализа активно обсуждался, и он также направил значительный новый акцент на понимание плюсов и минусов этих продуктов на фундаментальном физиологическом и механистическом уровнях.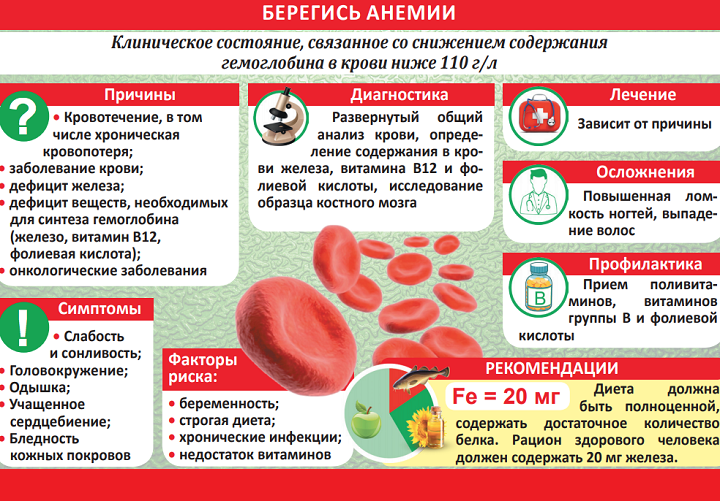 .С этой целью текущая категоризация таких продуктов была изменена с «заменителей эритроцитов» на «оксигенирующие терапевтические средства», чтобы подчеркнуть важную роль таких продуктов в сценариях, где настоящие эритроциты могут быть недостаточно доступны (например, далеко передовые военные действия). а также при перфузии трансплантируемых органов. В этой связи текущая статья будет посвящена обзору «переносчиков кислорода на основе гемоглобина» (HBOC), всестороннему обсуждению соответствующих конструкций, современного состояния и новых молекул, находящихся в разработке, а также подчеркиванию успехов и проблем.С этой целью будут подчеркнуты репрезентативные доклинические и клинические результаты, но не будут всесторонне обсуждаться результаты in vitro и in vivo отдельных дизайнов.
.С этой целью текущая категоризация таких продуктов была изменена с «заменителей эритроцитов» на «оксигенирующие терапевтические средства», чтобы подчеркнуть важную роль таких продуктов в сценариях, где настоящие эритроциты могут быть недостаточно доступны (например, далеко передовые военные действия). а также при перфузии трансплантируемых органов. В этой связи текущая статья будет посвящена обзору «переносчиков кислорода на основе гемоглобина» (HBOC), всестороннему обсуждению соответствующих конструкций, современного состояния и новых молекул, находящихся в разработке, а также подчеркиванию успехов и проблем.С этой целью будут подчеркнуты репрезентативные доклинические и клинические результаты, но не будут всесторонне обсуждаться результаты in vitro и in vivo отдельных дизайнов.
Функция гемоглобина (Hb) в эритроцитах по транспорту кислорода
В крови основной функцией эритроцитов является транспорт кислорода (O 2 ) и в некоторой степени диоксида углерода в ткани и из них за счет связывания газов в гемоглобин (Hb) в эритроцитах. Среднее количество Hb в эритроцитах взрослого человека (средний корпускулярный гемоглобин [MCH]) составляет от 27 до 31 пикограмм на клетку (~ 250 миллионов молекул Hb).Hb представляет собой тетрамерный белок, состоящий из двух α- и двух β-полипептидных цепей, каждая из которых состоит из железосодержащей гемовой группы, способной связывать одну молекулу кислорода (O 2 ). показывает многомасштабное представление эритроцитов, гемоглобина в эритроцитах и химической структуры железосодержащей «гемовой» группы в гемоглобине. Кинетика связывания O 2 с гемоглобином является положительно кооперативной, так что небольшое изменение парциального давления кислорода по мере того, как кровь движется от легких к тканям (), может привести к большим изменениям связанного (в легких) или высвобожденного (в ткани) кислорода. по Hb, как показано классической сигмоидальной формой кривой равновесия O 2 -связывания (OEC, ) (53, 54).Железо, содержащее O 2 в Hb, находится в восстановленном «железистом» состоянии (Fe 2+ ).
Среднее количество Hb в эритроцитах взрослого человека (средний корпускулярный гемоглобин [MCH]) составляет от 27 до 31 пикограмм на клетку (~ 250 миллионов молекул Hb).Hb представляет собой тетрамерный белок, состоящий из двух α- и двух β-полипептидных цепей, каждая из которых состоит из железосодержащей гемовой группы, способной связывать одну молекулу кислорода (O 2 ). показывает многомасштабное представление эритроцитов, гемоглобина в эритроцитах и химической структуры железосодержащей «гемовой» группы в гемоглобине. Кинетика связывания O 2 с гемоглобином является положительно кооперативной, так что небольшое изменение парциального давления кислорода по мере того, как кровь движется от легких к тканям (), может привести к большим изменениям связанного (в легких) или высвобожденного (в ткани) кислорода. по Hb, как показано классической сигмоидальной формой кривой равновесия O 2 -связывания (OEC, ) (53, 54).Железо, содержащее O 2 в Hb, находится в восстановленном «железистом» состоянии (Fe 2+ ). Когда Hb окисляется с образованием метгемоглобина (MetHb), железо окисляется до «трехвалентного» состояния (Fe 3+ ), которое не способно связывать кислород (55). По этой причине в естественных эритроцитах механизм переноса кислорода Hb тесно связан с окислительно-восстановительными циклами (например, под действием фермента NAD-цитохром b5 редуктазы), так что Fe 2+ -содержащий Hb может поддерживаться в его O 2 — состояние привязки.Необратимое превращение Hb в MetHb не только угнетает его кислородную способность, но и приводит к нарушению регуляции сосудистого тонуса и воспалительным реакциям. Кроме того, гемоглобин в эритроцитах обладает уникальной способностью претерпевать конформационные изменения, чтобы обеспечить насыщение (загрузку) O 2 в легких (более высокое сродство O 2 ), а затем высвобождение O 2 в тканевых капиллярах (более низкое O 2 сходство). Эта обратимая конформационная регуляция аффинности связывания O 2 с Hb поддерживается аллостерическими эффекторными молекулами, такими как 2,3-дифосфоглицерат (2,3-DPG), который образуется внутри эритроцитов в качестве промежуточного гликолитического соединения.
Когда Hb окисляется с образованием метгемоглобина (MetHb), железо окисляется до «трехвалентного» состояния (Fe 3+ ), которое не способно связывать кислород (55). По этой причине в естественных эритроцитах механизм переноса кислорода Hb тесно связан с окислительно-восстановительными циклами (например, под действием фермента NAD-цитохром b5 редуктазы), так что Fe 2+ -содержащий Hb может поддерживаться в его O 2 — состояние привязки.Необратимое превращение Hb в MetHb не только угнетает его кислородную способность, но и приводит к нарушению регуляции сосудистого тонуса и воспалительным реакциям. Кроме того, гемоглобин в эритроцитах обладает уникальной способностью претерпевать конформационные изменения, чтобы обеспечить насыщение (загрузку) O 2 в легких (более высокое сродство O 2 ), а затем высвобождение O 2 в тканевых капиллярах (более низкое O 2 сходство). Эта обратимая конформационная регуляция аффинности связывания O 2 с Hb поддерживается аллостерическими эффекторными молекулами, такими как 2,3-дифосфоглицерат (2,3-DPG), который образуется внутри эритроцитов в качестве промежуточного гликолитического соединения. Следовательно, поддержание термодинамических и кинетических характеристик гемоглобина, несущих кислород, поддержание окислительно-восстановительной среды и минимизация необратимого образования MetHb являются одними из важных и сложных соображений дизайна в контексте разработки суррогата эритроцитов на основе гемоглобина (56). В этом контексте важным фактором является поддержание физико-химической стабильности гемоглобина, поскольку вне защитного окружения эритроцитов (т. е. вне клеток или стромы) тетрамер гемоглобина склонен к быстрому распаду на димерные и мономерные белковые единицы, которые в свою очередь приводит к быстрому выведению из кровотока во внесосудистое пространство и почки.Это приводит к очень короткому времени пребывания в циркуляции и повышенному риску нефротоксичности. Hb без стромы также лишен регуляторных ферментов сродства к кислороду, таких как 2,3-DPG, а также защитных антиоксидантных ферментов. В результате такой гемоглобин имеет нарушенную способность оксигенации тканей по сравнению с гемоглобином, инкапсулированным в эритроциты, а также склонен к быстрому необратимому окислению до MetHb, тем самым теряя способность транспортировать кислород.
Следовательно, поддержание термодинамических и кинетических характеристик гемоглобина, несущих кислород, поддержание окислительно-восстановительной среды и минимизация необратимого образования MetHb являются одними из важных и сложных соображений дизайна в контексте разработки суррогата эритроцитов на основе гемоглобина (56). В этом контексте важным фактором является поддержание физико-химической стабильности гемоглобина, поскольку вне защитного окружения эритроцитов (т. е. вне клеток или стромы) тетрамер гемоглобина склонен к быстрому распаду на димерные и мономерные белковые единицы, которые в свою очередь приводит к быстрому выведению из кровотока во внесосудистое пространство и почки.Это приводит к очень короткому времени пребывания в циркуляции и повышенному риску нефротоксичности. Hb без стромы также лишен регуляторных ферментов сродства к кислороду, таких как 2,3-DPG, а также защитных антиоксидантных ферментов. В результате такой гемоглобин имеет нарушенную способность оксигенации тканей по сравнению с гемоглобином, инкапсулированным в эритроциты, а также склонен к быстрому необратимому окислению до MetHb, тем самым теряя способность транспортировать кислород. Свободный от стромы гемоглобин также является мощным поглотителем как внутри-, так и внесосудистого оксида азота (NO), который вырабатывается сосудистыми эндотелиальными клетками для врожденной вазодилататорной функции, и это связано с гипертоническими побочными эффектами гемоглобина.Таким образом, обеспечение эффективной оксигенации тканей при поддержании разумного времени циркуляции, минимизация гипертензивных побочных эффектов и предотвращение токсичности, вызванной гемоглобином, являются тремя основными требованиями к конструкции HBOC. В следующих разделах рассматриваются и обсуждаются различные подходы к проектированию, направленные на удовлетворение этих требований.
Свободный от стромы гемоглобин также является мощным поглотителем как внутри-, так и внесосудистого оксида азота (NO), который вырабатывается сосудистыми эндотелиальными клетками для врожденной вазодилататорной функции, и это связано с гипертоническими побочными эффектами гемоглобина.Таким образом, обеспечение эффективной оксигенации тканей при поддержании разумного времени циркуляции, минимизация гипертензивных побочных эффектов и предотвращение токсичности, вызванной гемоглобином, являются тремя основными требованиями к конструкции HBOC. В следующих разделах рассматриваются и обсуждаются различные подходы к проектированию, направленные на удовлетворение этих требований.

B. На нем показана схема движения эритроцитов между легкими (участок насыщения кислородом) и тканью (участок сброса кислорода), а (C) показаны соответствующие характеристики кривой кислородного равновесия (OEC) Hb. RBCs указывает на эритроциты.
Системы переносчиков кислорода (HBOC) на основе Hb
HBOC представляют собой полусинтетические системы, в которых природный Hb используется в качестве переносящего кислород компонента, либо в виде химически модифицированных бесклеточных суспензий, либо конъюгированных и сшитых с полимерами вместе с защитными ферментами, или инкапсулированные в носителях из микро- или наночастиц (51, 57).Hb, используемый в этих системах, обычно получают из устаревших человеческих или бычьих эритроцитов или из рекомбинантных источников (57–63). В случае устаревших человеческих или бычьих эритроцитов Hb выделяют путем лизиса клеток, очищают с помощью стерильной фильтрации и хроматографических методов и стерилизуют (например, при слабом нагревании) (64). Использование бесклеточного гемоглобина имеет преимущество минимальной антигенности и способности более эффективно выводить кислород из плазмы из-за отсутствия помех со стороны клеточной мембраны. Фактически, по сообщениям, в начале 20 века суспензия бесклеточного гемоглобина в растворе Рингера с лактатом использовалась для внутривенного лечения 15 пациентов; однако у большого числа из них развилась нефротоксичность и сердечно-сосудистые осложнения (64).Подобные результаты были также получены в 1950-х годах, когда ВМС США лечили нескольких пациентов с бесклеточным гемоглобином (65). Также было обнаружено, что бесклеточный Hb имеет очень короткое время пребывания в циркуляции, поскольку тетрамер Hb быстро диссоциирует на димерные и мономерные формы, которые могут связываться с иммуноглобулинами плазмы и подвергаться быстрому клиренсу ретикуло-эндотелиальной системой в селезенку и печень, а также как почечный клиренс в почки, что приводит к индуцированной гемоглобином токсичности в этих органах (66, 67).
Использование бесклеточного гемоглобина имеет преимущество минимальной антигенности и способности более эффективно выводить кислород из плазмы из-за отсутствия помех со стороны клеточной мембраны. Фактически, по сообщениям, в начале 20 века суспензия бесклеточного гемоглобина в растворе Рингера с лактатом использовалась для внутривенного лечения 15 пациентов; однако у большого числа из них развилась нефротоксичность и сердечно-сосудистые осложнения (64).Подобные результаты были также получены в 1950-х годах, когда ВМС США лечили нескольких пациентов с бесклеточным гемоглобином (65). Также было обнаружено, что бесклеточный Hb имеет очень короткое время пребывания в циркуляции, поскольку тетрамер Hb быстро диссоциирует на димерные и мономерные формы, которые могут связываться с иммуноглобулинами плазмы и подвергаться быстрому клиренсу ретикуло-эндотелиальной системой в селезенку и печень, а также как почечный клиренс в почки, что приводит к индуцированной гемоглобином токсичности в этих органах (66, 67). Кроме того, бесклеточный Hb и его диссоциированные производные также могут проникать в субэндотелиальный домен кровеносной системы и быстро связывать NO, что приводит к его превращению в нитрат (реакция диоксигенации) и окси-Hb в Met-Hb (68).NO является естественным сосудорасширяющим средством организма, и, следовательно, удаление NO приводит к вазоконстрикции и сердечно-сосудистым осложнениям. Кроме того, отсутствие 2,3-DPG в бесклеточном гемоглобине может вызвать неестественно высокое сродство к кислороду, что делает проблематичным разгрузку O 2 . Бесклеточный Hb также может изменять осмолярность крови, что приводит к изменению объема крови и связанным с этим побочным эффектам. В целом, по этим причинам бесклеточный гемоглобин человека считается проблематичным для in vivo приложений, несущих кислород.Вместо человеческого гемоглобина исследования также проводились с бычьим гемоглобином, но это также связано с аналогичными проблемами стабильности, экстравазации, удаления NO, почечного клиренса и токсичности.
Кроме того, бесклеточный Hb и его диссоциированные производные также могут проникать в субэндотелиальный домен кровеносной системы и быстро связывать NO, что приводит к его превращению в нитрат (реакция диоксигенации) и окси-Hb в Met-Hb (68).NO является естественным сосудорасширяющим средством организма, и, следовательно, удаление NO приводит к вазоконстрикции и сердечно-сосудистым осложнениям. Кроме того, отсутствие 2,3-DPG в бесклеточном гемоглобине может вызвать неестественно высокое сродство к кислороду, что делает проблематичным разгрузку O 2 . Бесклеточный Hb также может изменять осмолярность крови, что приводит к изменению объема крови и связанным с этим побочным эффектам. В целом, по этим причинам бесклеточный гемоглобин человека считается проблематичным для in vivo приложений, несущих кислород.Вместо человеческого гемоглобина исследования также проводились с бычьим гемоглобином, но это также связано с аналогичными проблемами стабильности, экстравазации, удаления NO, почечного клиренса и токсичности.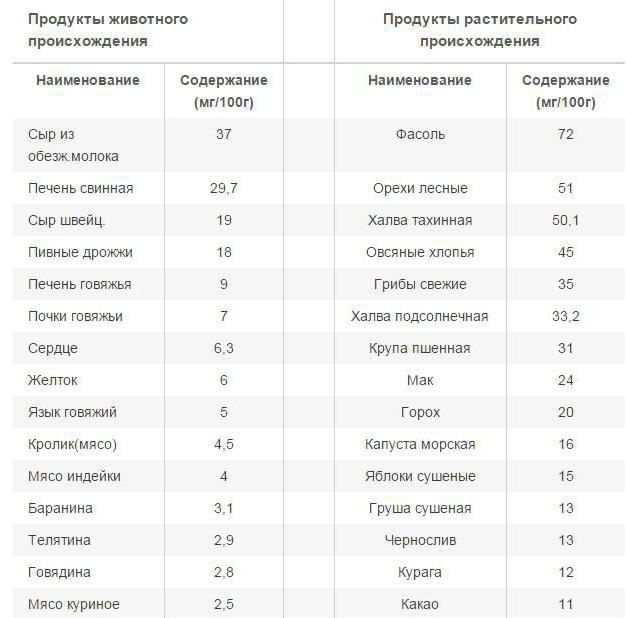 Еще одним интересным способом решения некоторых из этих проблем является разработка рекомбинантного гемоглобина (например, в E coli) , где специфические мутации могут способствовать уменьшению диссоциации и модуляции способности связывания NO, но правильная комбинация мутаций, которые могут привести к идеальный дизайн гемоглобина еще предстоит установить (69–71).Рекомбинантные технологии также значительно дороже по сравнению с человеческим или бычьим Hb. Таким образом, значительный объем исследований был сосредоточен на стабилизации in vivo и функциональной модуляции гемоглобина с использованием химических модификаций, таких как сшивка, полимеризация и конъюгация поверхности макромеров. Целью этих модификаций является уменьшение диссоциации гемоглобина, его экстравазации и почечного клиренса при сохранении приемлемого времени жизни циркуляции и O 2 -транспортной способности.
Еще одним интересным способом решения некоторых из этих проблем является разработка рекомбинантного гемоглобина (например, в E coli) , где специфические мутации могут способствовать уменьшению диссоциации и модуляции способности связывания NO, но правильная комбинация мутаций, которые могут привести к идеальный дизайн гемоглобина еще предстоит установить (69–71).Рекомбинантные технологии также значительно дороже по сравнению с человеческим или бычьим Hb. Таким образом, значительный объем исследований был сосредоточен на стабилизации in vivo и функциональной модуляции гемоглобина с использованием химических модификаций, таких как сшивка, полимеризация и конъюгация поверхности макромеров. Целью этих модификаций является уменьшение диссоциации гемоглобина, его экстравазации и почечного клиренса при сохранении приемлемого времени жизни циркуляции и O 2 -транспортной способности.
Химически модифицированные HBOC—
Hb может быть сшит как внутри-, так и межмолекулярно. Например, внутримолекулярное сшивание в человеческом гемоглобине, образованном между двумя его а-субъединицами с помощью ацилирования бис-(3,5-дибромсалицил)фумаратом (также известным как диаспирин), привело к получению продукта под названием HemAssist от Baxter (Чикаго, Иллинойс). 57, 72, 73). Этот продукт показал увеличение времени пребывания в кровотоке до 12 часов по сравнению с <6 часов для немодифицированного гемоглобина, но, к сожалению, перекрестно-сшитый гемоглобин показал 72-процентное увеличение уровня смертности у людей по сравнению с физиологическим раствором, и клинические испытания были прекращены (74). ).Аналогичный подход к перекрестному связыванию α-субъединиц рекомбинантного гемоглобина с использованием глицина привел к получению продукта под названием Optro от Somatogen (Boulder, Colo), но это также привело к повышенному риску остановки сердца и смертности (75–77). Вместо только сайт-специфического внутримолекулярного сшивания, полимеризованный гемоглобин также был создан с использованием бифункциональных сшивающих реагентов, таких как сшивка бычьего гемоглобина на основе глутарового альдегида (например, Hemopure первоначально от Biopure, Кембридж, Массачусетс, теперь HbO 2 Therapeutics).
Например, внутримолекулярное сшивание в человеческом гемоглобине, образованном между двумя его а-субъединицами с помощью ацилирования бис-(3,5-дибромсалицил)фумаратом (также известным как диаспирин), привело к получению продукта под названием HemAssist от Baxter (Чикаго, Иллинойс). 57, 72, 73). Этот продукт показал увеличение времени пребывания в кровотоке до 12 часов по сравнению с <6 часов для немодифицированного гемоглобина, но, к сожалению, перекрестно-сшитый гемоглобин показал 72-процентное увеличение уровня смертности у людей по сравнению с физиологическим раствором, и клинические испытания были прекращены (74). ).Аналогичный подход к перекрестному связыванию α-субъединиц рекомбинантного гемоглобина с использованием глицина привел к получению продукта под названием Optro от Somatogen (Boulder, Colo), но это также привело к повышенному риску остановки сердца и смертности (75–77). Вместо только сайт-специфического внутримолекулярного сшивания, полимеризованный гемоглобин также был создан с использованием бифункциональных сшивающих реагентов, таких как сшивка бычьего гемоглобина на основе глутарового альдегида (например, Hemopure первоначально от Biopure, Кембридж, Массачусетс, теперь HbO 2 Therapeutics). , Содертон, Пенсильвания) или Hb человека (e.g., PolyHeme от Northfield Labs, Эванстон, Иллинойс) и перекрестное связывание гемоглобина человека на основе о-рафинозы (например, продукт HemoLink от Hemosol, Торонто, Онтарио, Канада) (78, 79). Такое сшивание позволяет получить бесклеточный гемоглобин с более высокой молекулярной массой, который сохраняет свойства переноса кислорода, минимизируя при этом диссоциацию и быстрый клиренс гемоглобина. Одной из проблем этих подходов является точное регулирование молекулярной массы полимера, а для обеспечения качества продукта необходимы строгие этапы очистки. Сообщалось, что PolyHeme переходит в фазу III клинических испытаний в Соединенных Штатах для лечения кровопотери, связанной с травмой, и показал снижение потребности в естественных переливаниях крови (77).Клинические испытания HemoPure также показали снижение потребности в дополнительных переливаниях крови при кардиохирургии (80). HemoPure получил клиническое одобрение в Южной Африке для лечения пациентов с острой анемией и проходит фазу III клинических испытаний в США.
, Содертон, Пенсильвания) или Hb человека (e.g., PolyHeme от Northfield Labs, Эванстон, Иллинойс) и перекрестное связывание гемоглобина человека на основе о-рафинозы (например, продукт HemoLink от Hemosol, Торонто, Онтарио, Канада) (78, 79). Такое сшивание позволяет получить бесклеточный гемоглобин с более высокой молекулярной массой, который сохраняет свойства переноса кислорода, минимизируя при этом диссоциацию и быстрый клиренс гемоглобина. Одной из проблем этих подходов является точное регулирование молекулярной массы полимера, а для обеспечения качества продукта необходимы строгие этапы очистки. Сообщалось, что PolyHeme переходит в фазу III клинических испытаний в Соединенных Штатах для лечения кровопотери, связанной с травмой, и показал снижение потребности в естественных переливаниях крови (77).Клинические испытания HemoPure также показали снижение потребности в дополнительных переливаниях крови при кардиохирургии (80). HemoPure получил клиническое одобрение в Южной Африке для лечения пациентов с острой анемией и проходит фазу III клинических испытаний в США. Аналогичный продукт той же компании (HbO 2 Therapeutics, США) под названием Oxyglobin в настоящее время одобрен в США для ветеринарного применения. Сообщается, что HemoLink также прошел клинические испытания фазы III, но был прекращен в 2003 году, когда у пациентов, получавших лечение, возникли неблагоприятные сердечные события.На самом деле, все эти продукты в своих клинических исследованиях продемонстрировали преходящую гипертензию различной степени, повреждение органов из-за сужения и дисфункции микрососудов, желудочно-кишечные расстройства, нефротоксичность, нейротоксичность и повышенную смертность (80–82).
Аналогичный продукт той же компании (HbO 2 Therapeutics, США) под названием Oxyglobin в настоящее время одобрен в США для ветеринарного применения. Сообщается, что HemoLink также прошел клинические испытания фазы III, но был прекращен в 2003 году, когда у пациентов, получавших лечение, возникли неблагоприятные сердечные события.На самом деле, все эти продукты в своих клинических исследованиях продемонстрировали преходящую гипертензию различной степени, повреждение органов из-за сужения и дисфункции микрососудов, желудочно-кишечные расстройства, нефротоксичность, нейротоксичность и повышенную смертность (80–82).
Вместо внутримолекулярного сшивания и межмолекулярной полимеризации модификация гемоглобина также проводилась с помощью макромерной биоконъюгации для повышения стабильности и времени пребывания в сосудах при одновременном снижении распознавания иммунной системой (83–85).Важные примеры этого подхода можно найти в полиэтиленгликолевой (ПЭГ) модификации Hb (например, продукты Hemospan от Sangart Inc, Сан-Диего, Калифорния, и PEG-Hb от Enzon, South Plainfield, NJ) и поли(оксиэтиленовой) модификации Hb. пиридоксилированный сшитый Hb (например, продукт PHP от Apex Bioscience, Durham, NC). ПЭГ-илированные продукты гемоглобина прошли обширные клинические испытания, и исследования показали риск брадикардии и повышения активности печеночных ферментов поджелудочной железы даже при низких дозах (86).Тем не менее, клинические испытания Фазы I и Фазы II показали, что Гемоспан хорошо переносится людьми для эффективной доставки кислорода, а испытания Фазы III у пациентов ортопедической хирургии проводились в Европе. Испытания показали, что риск сердечно-сосудистых и почечных дисфункций все еще сохраняется при использовании таких химически модифицированных продуктов гемоглобина (87). Такие продукты, как PHP, также указывают на такие риски сердечно-сосудистых и почечных дисфункций. За последние два десятилетия было установлено, что бесклеточный гемоглобин (включая химически модифицированные версии) является мощным поглотителем оксида азота (NO) посредством быстрого необратимого связывания (константа скорости ~ 10 7 М -1 с -1 ), что, в свою очередь, может влиять на тонус системных и легочных сосудов, приводя к вазоконстрикции, гипертензии и снижению сердечного выброса (88, 89).
пиридоксилированный сшитый Hb (например, продукт PHP от Apex Bioscience, Durham, NC). ПЭГ-илированные продукты гемоглобина прошли обширные клинические испытания, и исследования показали риск брадикардии и повышения активности печеночных ферментов поджелудочной железы даже при низких дозах (86).Тем не менее, клинические испытания Фазы I и Фазы II показали, что Гемоспан хорошо переносится людьми для эффективной доставки кислорода, а испытания Фазы III у пациентов ортопедической хирургии проводились в Европе. Испытания показали, что риск сердечно-сосудистых и почечных дисфункций все еще сохраняется при использовании таких химически модифицированных продуктов гемоглобина (87). Такие продукты, как PHP, также указывают на такие риски сердечно-сосудистых и почечных дисфункций. За последние два десятилетия было установлено, что бесклеточный гемоглобин (включая химически модифицированные версии) является мощным поглотителем оксида азота (NO) посредством быстрого необратимого связывания (константа скорости ~ 10 7 М -1 с -1 ), что, в свою очередь, может влиять на тонус системных и легочных сосудов, приводя к вазоконстрикции, гипертензии и снижению сердечного выброса (88, 89). Была предпринята попытка решить эту проблему путем модификации молекулы гемоглобина с целью превращения ее в переносчика NO за счет S-нитрозилирования остатков цистеина в β-субъединицах гемоглобина или придания гемоглобину способности к ферментативному превращению в исходный донор NO в присутствии нитритов. , но пока с ограниченным успехом, in vivo (90). Естественные эритроциты содержат ферменты, такие как каталаза (CAT) и супероксиддисмутаза (SOD), которые помогают смягчить окислительный стресс, возникающий из-за супероксидных фрагментов в поврежденных и ишемизированных тканях.Основываясь на этом обосновании, в интересном подходе эти ферменты были сшиты с полимеризованным Hb с образованием PolyHb-SOD-CAT, что показало комбинированные преимущества длительного времени циркуляции и уменьшения окислительного повреждения (91, 92). Другим интересным подходом является включение регуляторных молекул, таких как 2,3-DPG и метгемоглобинредуктаза, вместе с гемоглобином в соответствующие системы HBOC для предотвращения окисления гемоглобина.
Была предпринята попытка решить эту проблему путем модификации молекулы гемоглобина с целью превращения ее в переносчика NO за счет S-нитрозилирования остатков цистеина в β-субъединицах гемоглобина или придания гемоглобину способности к ферментативному превращению в исходный донор NO в присутствии нитритов. , но пока с ограниченным успехом, in vivo (90). Естественные эритроциты содержат ферменты, такие как каталаза (CAT) и супероксиддисмутаза (SOD), которые помогают смягчить окислительный стресс, возникающий из-за супероксидных фрагментов в поврежденных и ишемизированных тканях.Основываясь на этом обосновании, в интересном подходе эти ферменты были сшиты с полимеризованным Hb с образованием PolyHb-SOD-CAT, что показало комбинированные преимущества длительного времени циркуляции и уменьшения окислительного повреждения (91, 92). Другим интересным подходом является включение регуляторных молекул, таких как 2,3-DPG и метгемоглобинредуктаза, вместе с гемоглобином в соответствующие системы HBOC для предотвращения окисления гемоглобина. В последние годы сообщалось о продукте под названием HemoTech, в котором используется очищенный бычий гемоглобин, поперечно связанный внутримолекулярно с АТФ и межмолекулярно с аденозином, а также конъюгированный с восстановленным глутатионом (GSH) (93).Этот уникальный дизайн позволяет использовать фармакологически активные молекулы (АТФ, аденозин и GSH) в качестве химических модификаторов, где АТФ регулирует тонус сосудов через пуринаргические рецепторы, аденозин противодействует вазоконстрикторным свойствам Hb посредством стимуляции аденозиновых рецепторов, а GSH защищает «гемовые рецепторы». ” из NO и различных активных форм кислорода. Доклинические и ранние клинические исследования показали, что HemoTech действует как эффективный переносчик кислорода при лечении кровопотери, анемии и ишемических сосудистых состояний, и необходимы дальнейшие исследования.Другим полимерным гемоглобином, о котором сообщалось в последние годы, является OxyVita, который производится путем модификации механизма полимеризации с нулевой связью с использованием химии карбодиимидов на бычьем тетрамерном гемоглобине для получения «суперполимерных» макромолекул (94).
В последние годы сообщалось о продукте под названием HemoTech, в котором используется очищенный бычий гемоглобин, поперечно связанный внутримолекулярно с АТФ и межмолекулярно с аденозином, а также конъюгированный с восстановленным глутатионом (GSH) (93).Этот уникальный дизайн позволяет использовать фармакологически активные молекулы (АТФ, аденозин и GSH) в качестве химических модификаторов, где АТФ регулирует тонус сосудов через пуринаргические рецепторы, аденозин противодействует вазоконстрикторным свойствам Hb посредством стимуляции аденозиновых рецепторов, а GSH защищает «гемовые рецепторы». ” из NO и различных активных форм кислорода. Доклинические и ранние клинические исследования показали, что HemoTech действует как эффективный переносчик кислорода при лечении кровопотери, анемии и ишемических сосудистых состояний, и необходимы дальнейшие исследования.Другим полимерным гемоглобином, о котором сообщалось в последние годы, является OxyVita, который производится путем модификации механизма полимеризации с нулевой связью с использованием химии карбодиимидов на бычьем тетрамерном гемоглобине для получения «суперполимерных» макромолекул (94). В еще одном недавнем подходе сообщалось о дизайне наноструктуры полинитроксилированного ПЭГ-илированного гемоглобина (PNPH), названного VitalHeme (SynZyme Technologies LLC, Ирвин, Калифорния), где ПЭГ-илированный гемоглобин ковалентно модифицирован каталитической клеткой NO (95).Сообщается, что эти конструкции обеспечивают более высокую стабильность гемоглобина in vivo и в настоящее время проходят доклинические исследования. показаны некоторые известные конструкции, основанные на химической модификации бесклеточного гемоглобина, которые прошли (или все еще проходят) доклинические и клинические испытания транспорта кислорода. Несмотря на многообещающие доклинические и клинические результаты, многие из химически модифицированных продуктов гемоглобина были отозваны из клинических исследований и прекращены в производстве из-за того, что у них больше клинических рисков, чем пользы, что связано с химической гетерогенностью и переменной стабильностью конечного продукта, субоптимальным временем пребывания в сосудах.
В еще одном недавнем подходе сообщалось о дизайне наноструктуры полинитроксилированного ПЭГ-илированного гемоглобина (PNPH), названного VitalHeme (SynZyme Technologies LLC, Ирвин, Калифорния), где ПЭГ-илированный гемоглобин ковалентно модифицирован каталитической клеткой NO (95).Сообщается, что эти конструкции обеспечивают более высокую стабильность гемоглобина in vivo и в настоящее время проходят доклинические исследования. показаны некоторые известные конструкции, основанные на химической модификации бесклеточного гемоглобина, которые прошли (или все еще проходят) доклинические и клинические испытания транспорта кислорода. Несмотря на многообещающие доклинические и клинические результаты, многие из химически модифицированных продуктов гемоглобина были отозваны из клинических исследований и прекращены в производстве из-за того, что у них больше клинических рисков, чем пользы, что связано с химической гетерогенностью и переменной стабильностью конечного продукта, субоптимальным временем пребывания в сосудах. , неидеальные возможности кислородной загрузки и разгрузки, быстрое необратимое преобразование в метгемоглобин и усиление проблем с сердечно-сосудистой и почечной дисфункцией.В то время как некоторые из более новых продуктов совершенствуют свой дизайн и обработку для решения этих проблем, параллельное направление исследований было сосредоточено на инкапсулировании гемоглобина в различные микро- и наноносители, чтобы более точно имитировать физиологическое инкапсулированное состояние гемоглобина в организме. эритроциты.
, неидеальные возможности кислородной загрузки и разгрузки, быстрое необратимое преобразование в метгемоглобин и усиление проблем с сердечно-сосудистой и почечной дисфункцией.В то время как некоторые из более новых продуктов совершенствуют свой дизайн и обработку для решения этих проблем, параллельное направление исследований было сосредоточено на инкапсулировании гемоглобина в различные микро- и наноносители, чтобы более точно имитировать физиологическое инкапсулированное состояние гемоглобина в организме. эритроциты.
Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
Инкапсулированные системы HBOC —
За последние два десятилетия технологии доставки лекарств в виде частиц (микрочастицы и наночастицы) произвели революцию в упаковке и доставке фармацевтических соединений путем их инкапсулирования внутри таких частиц, чтобы защитить их от эффектов, вызванных плазмой, увеличить их время циркуляции и обеспечивают постоянную доступность для клеток, тканей и органов. Эта концепция дизайна также была адаптирована для создания HBOC, которые инкапсулируют Hb в подходящие транспортные средства в виде твердых частиц.Фактически, новаторская концепция и демонстрация «биоискусственных клеток» была представлена еще в 1950-х и 1960-х годах Chang et al. путем инкапсуляции Hb, а также других белков и ферментов в микровезикулы на основе полимерных мембран. Первоначально в качестве мембранного материала использовался коллодий (нитрат целлюлозы), который позже был заменен на биоразлагаемый полиэтиленгликоль-полилактид (PEG-PLA) (96, 97). Эти наполненные гемоглобином микровезикулы, метко названные «гемоглобиновыми тельцами», демонстрируют кривые равновесия кислорода, сходные с эритроцитами, а также допускают коинкапсуляцию и активность ферментов, связанных с эритроцитами, таких как 2,3-дифосфоглицерат (2,3-ДФГ), карбоангидраза, и КПП (98–100).Однако в этих системах серьезной проблемой было быстрое поглощение макрофагами и выведение этих микрометровых везикул из кровотока, что приводило к субоптимальному времени пребывания в кровотоке для применения in vivo .
Эта концепция дизайна также была адаптирована для создания HBOC, которые инкапсулируют Hb в подходящие транспортные средства в виде твердых частиц.Фактически, новаторская концепция и демонстрация «биоискусственных клеток» была представлена еще в 1950-х и 1960-х годах Chang et al. путем инкапсуляции Hb, а также других белков и ферментов в микровезикулы на основе полимерных мембран. Первоначально в качестве мембранного материала использовался коллодий (нитрат целлюлозы), который позже был заменен на биоразлагаемый полиэтиленгликоль-полилактид (PEG-PLA) (96, 97). Эти наполненные гемоглобином микровезикулы, метко названные «гемоглобиновыми тельцами», демонстрируют кривые равновесия кислорода, сходные с эритроцитами, а также допускают коинкапсуляцию и активность ферментов, связанных с эритроцитами, таких как 2,3-дифосфоглицерат (2,3-ДФГ), карбоангидраза, и КПП (98–100).Однако в этих системах серьезной проблемой было быстрое поглощение макрофагами и выведение этих микрометровых везикул из кровотока, что приводило к субоптимальному времени пребывания в кровотоке для применения in vivo . Уменьшение диаметра до ~ 1 мкм лишь незначительно улучшило продолжительность циркуляции, и значительные исследовательские усилия были направлены на дальнейшее улучшение времени пребывания в сосудах путем модификации поверхности везикул липидами и полисахаридами. В другом подобном подходе к дизайну Djordjevich et al. сообщили об инкапсулировании Hb в липидные везикулы микронного и субмикронного размера (Hb, инкапсулированные в липосомы или LEH), с мембраной, состоящей из фосфолипидов и холестерина (101–103).Этот дизайн по существу имитирует физиологическое состояние Hb в эритроцитах, где он защищен липидной клеточной мембраной, которая сохраняет подходящие окислительно-восстановительные механизмы для функции Hb. Затем последовал ряд вариаций этого дизайна, например, «неогемоциты», «TRM-645 Neo Red Cells» и т. д., где основное внимание уделялось поддержанию одинаковых уровней инкапсуляции гемоглобина, равномерного распределения размеров везикул, минимизации везикул. дестабилизация или слияние с течением времени и повышают стабильность везикул при хранении, сохраняя при этом свойства транспорта кислорода, аналогичные эритроцитам, инкапсулированного гемоглобина (104–106).
Уменьшение диаметра до ~ 1 мкм лишь незначительно улучшило продолжительность циркуляции, и значительные исследовательские усилия были направлены на дальнейшее улучшение времени пребывания в сосудах путем модификации поверхности везикул липидами и полисахаридами. В другом подобном подходе к дизайну Djordjevich et al. сообщили об инкапсулировании Hb в липидные везикулы микронного и субмикронного размера (Hb, инкапсулированные в липосомы или LEH), с мембраной, состоящей из фосфолипидов и холестерина (101–103).Этот дизайн по существу имитирует физиологическое состояние Hb в эритроцитах, где он защищен липидной клеточной мембраной, которая сохраняет подходящие окислительно-восстановительные механизмы для функции Hb. Затем последовал ряд вариаций этого дизайна, например, «неогемоциты», «TRM-645 Neo Red Cells» и т. д., где основное внимание уделялось поддержанию одинаковых уровней инкапсуляции гемоглобина, равномерного распределения размеров везикул, минимизации везикул. дестабилизация или слияние с течением времени и повышают стабильность везикул при хранении, сохраняя при этом свойства транспорта кислорода, аналогичные эритроцитам, инкапсулированного гемоглобина (104–106). В 1990-х годах была клинически освоена технология «невидимых липосом», в которой липидные нановезикулы (диаметром 100–200 нм) функционализировались на поверхности полиэтиленгликолем (ПЭГ) для повышения стабильности при хранении, уменьшения опсонизации и предотвращения быстрого поглощения макрофагами. значительно увеличилось время пребывания в циркуляции (107, 108). Следовательно, эта технология была адаптирована для формирования Hb-инкапсулированных PEG-илированных липосомальных везикул (HbV) (109–111). Для получения HbV в качестве основного мембранного фосфолипида использовали 1,2-диоктадекадиеноил-sn-глицеро-3-фосфатидилхолин (ДОДФХ), так что вызванный γ-облучением радиолиз молекул воды в везикулах генерировал гидроксильные (–ОН) радикалы, которые способствовал межмолекулярной полимеризации диеноильных групп с получением высокостабильных липосом, которые могли выдерживать процессы замораживания-оттаивания, сушки вымораживанием и регидратации.Дизайн HbV привел к значительному увеличению продолжительности кровообращения (~ 60 часов в некоторых животных моделях), и в последние годы сообщалось о нескольких усовершенствованиях этого дизайна (112–116).
В 1990-х годах была клинически освоена технология «невидимых липосом», в которой липидные нановезикулы (диаметром 100–200 нм) функционализировались на поверхности полиэтиленгликолем (ПЭГ) для повышения стабильности при хранении, уменьшения опсонизации и предотвращения быстрого поглощения макрофагами. значительно увеличилось время пребывания в циркуляции (107, 108). Следовательно, эта технология была адаптирована для формирования Hb-инкапсулированных PEG-илированных липосомальных везикул (HbV) (109–111). Для получения HbV в качестве основного мембранного фосфолипида использовали 1,2-диоктадекадиеноил-sn-глицеро-3-фосфатидилхолин (ДОДФХ), так что вызванный γ-облучением радиолиз молекул воды в везикулах генерировал гидроксильные (–ОН) радикалы, которые способствовал межмолекулярной полимеризации диеноильных групп с получением высокостабильных липосом, которые могли выдерживать процессы замораживания-оттаивания, сушки вымораживанием и регидратации.Дизайн HbV привел к значительному увеличению продолжительности кровообращения (~ 60 часов в некоторых животных моделях), и в последние годы сообщалось о нескольких усовершенствованиях этого дизайна (112–116).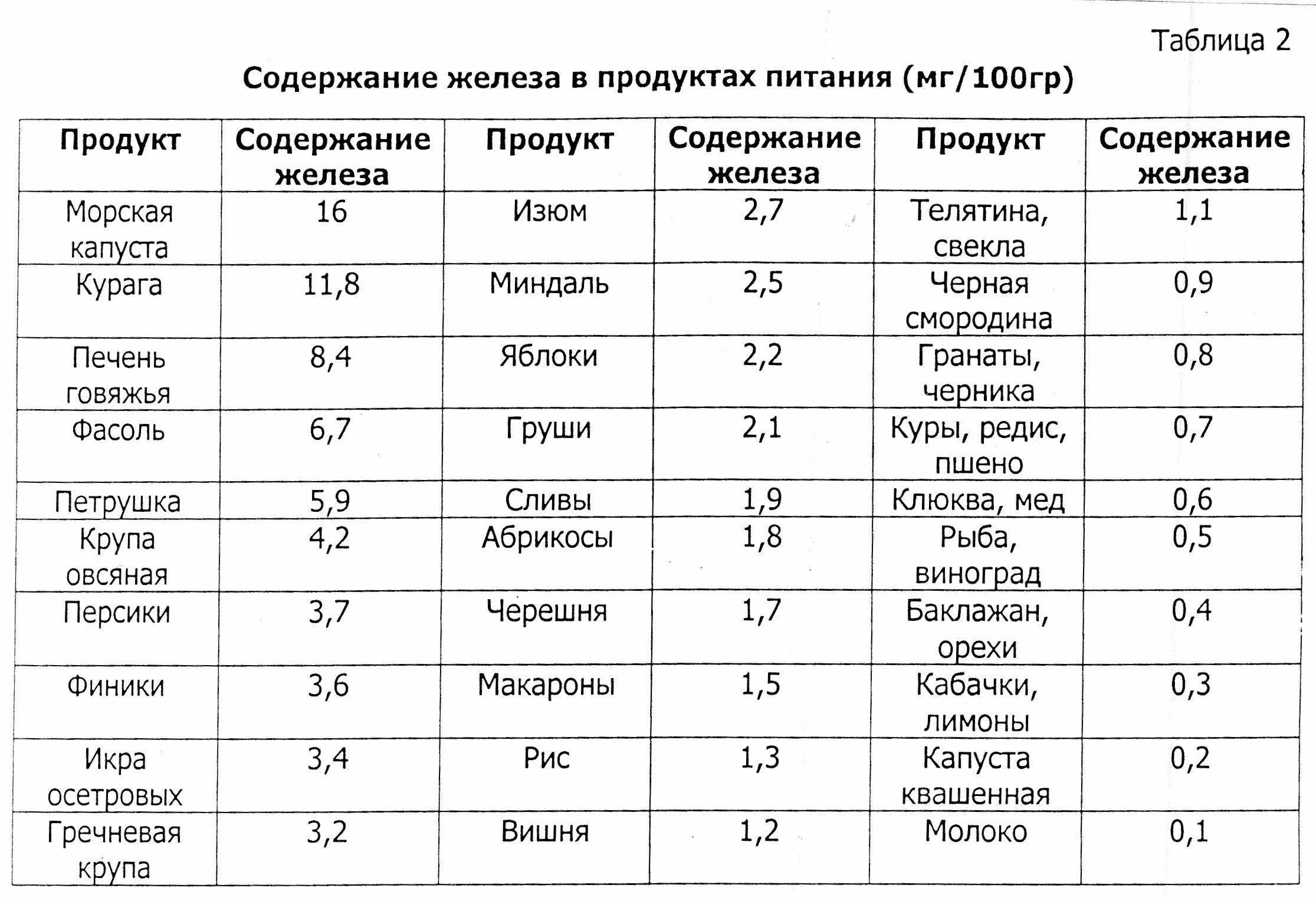 Было обнаружено, что кислородтранспортная способность HbV аналогична природным эритроцитам с сопоставимой кинетикой насыщения кислородом и высвобождения. Кроме того, липосомальная инкапсуляция гемоглобина предотвратила его эффект поглощения NO и, таким образом, уменьшила связанные с этим негативные эффекты на сосудистую сеть. Инкапсуляция гемоглобина в липосомальные везикулы также предотвращает гломерулярный клиренс гемоглобина (поскольку липосомы слишком велики для почечного клиренса) и, следовательно, снижает нефротоксичность.Текущий оптимизированный продукт HbV содержит около 30 000 молекул Hb, инкапсулированных в одной ПЭГ-илированной липосомальной везикуле диаметром ~ 250 нм. Для сравнения, естественный эритроцит имеет диаметр ~7 мкм и толщину ~2 мкм и содержит около 250 миллионов молекул гемоглобина. HbV прошли обширную доклиническую оценку на подходящих моделях животных для потенциального использования в качестве суррогата эритроцитов при переливании крови и реанимации для смягчения последствий массивного геморрагического шока и случаев гемодилюции, а также для оксигенации ишемизированных, а также трансплантированных тканей и органов.
Было обнаружено, что кислородтранспортная способность HbV аналогична природным эритроцитам с сопоставимой кинетикой насыщения кислородом и высвобождения. Кроме того, липосомальная инкапсуляция гемоглобина предотвратила его эффект поглощения NO и, таким образом, уменьшила связанные с этим негативные эффекты на сосудистую сеть. Инкапсуляция гемоглобина в липосомальные везикулы также предотвращает гломерулярный клиренс гемоглобина (поскольку липосомы слишком велики для почечного клиренса) и, следовательно, снижает нефротоксичность.Текущий оптимизированный продукт HbV содержит около 30 000 молекул Hb, инкапсулированных в одной ПЭГ-илированной липосомальной везикуле диаметром ~ 250 нм. Для сравнения, естественный эритроцит имеет диаметр ~7 мкм и толщину ~2 мкм и содержит около 250 миллионов молекул гемоглобина. HbV прошли обширную доклиническую оценку на подходящих моделях животных для потенциального использования в качестве суррогата эритроцитов при переливании крови и реанимации для смягчения последствий массивного геморрагического шока и случаев гемодилюции, а также для оксигенации ишемизированных, а также трансплантированных тканей и органов.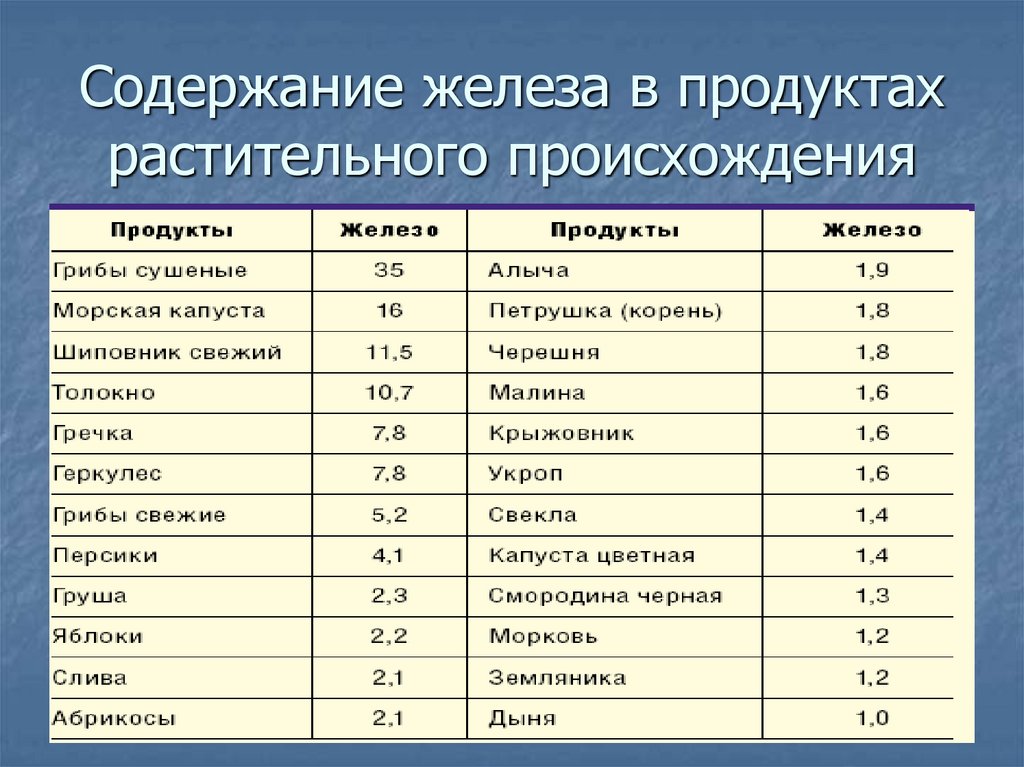 Эти исследования показали значительные перспективы использования HbV в качестве носителей кислорода, вдохновленных эритроцитами; тем не менее, эти системы все еще могут представлять проблемы широкого распределения размеров носителей, различий в эффективности инкапсуляции Hb, различной фармакокинетики и комплемент-опосредованного иммунного ответа in vivo . Дальнейшие исследования в настоящее время направлены на решение этих вопросов для возможного клинического применения дизайнов HbV, а также других аналогичных дизайнов систем гемоглобина, инкапсулированного в липосомы (LEH), заменителей эритроцитов (112–116).Интересно, что вместо инкапсуляции гемоглобина некоторые недавние исследовательские подходы также пытались инкапсулировать кислород (O 2 ) непосредственно в фосфолипидные микровезикулы (диаметром 2–4 мкм) для доставки O 2 в деоксигенированные эритроциты в кровотоке (117, 118). ). Хотя было обнаружено, что эти наполненные кислородом микропузырьки стабильны в течение нескольких недель при хранении с лишь небольшой степенью потери кислорода, in vivo они имеют очень короткое время жизни в циркуляции (<1 часа).
Эти исследования показали значительные перспективы использования HbV в качестве носителей кислорода, вдохновленных эритроцитами; тем не менее, эти системы все еще могут представлять проблемы широкого распределения размеров носителей, различий в эффективности инкапсуляции Hb, различной фармакокинетики и комплемент-опосредованного иммунного ответа in vivo . Дальнейшие исследования в настоящее время направлены на решение этих вопросов для возможного клинического применения дизайнов HbV, а также других аналогичных дизайнов систем гемоглобина, инкапсулированного в липосомы (LEH), заменителей эритроцитов (112–116).Интересно, что вместо инкапсуляции гемоглобина некоторые недавние исследовательские подходы также пытались инкапсулировать кислород (O 2 ) непосредственно в фосфолипидные микровезикулы (диаметром 2–4 мкм) для доставки O 2 в деоксигенированные эритроциты в кровотоке (117, 118). ). Хотя было обнаружено, что эти наполненные кислородом микропузырьки стабильны в течение нескольких недель при хранении с лишь небольшой степенью потери кислорода, in vivo они имеют очень короткое время жизни в циркуляции (<1 часа). Следовательно, лечение этими системами потребует многократных или повторных дозировок, что может привести к негативным последствиям нарушения регуляции окислительного стресса и связанной с ним токсичности и иммунного ответа. Следовательно, необходимо тщательно оценить долгосрочный профиль безопасности таких технологий. Инкапсуляция Hb также изучалась в других системах микро- и наночастиц, помимо липидных везикул. В новаторской работе Chang et al. Hb был инкапсулирован в полимерные наночастицы (диаметром 80–200 нм), изготовленные из PEG-PLA и аналогичных блок-сополимеров (119, 120).Эти полимерные наночастицы могут обеспечить кинетику переноса кислорода для гемоглобина на уровне, аналогичном естественным эритроцитам, а полимерный материал может быть спроектирован так, чтобы быть биосовместимым и биоразлагаемым. Кроме того, ферменты, которые поддерживают окислительно-восстановительную среду для стабильности и регуляции функции гемоглобина (например, карбоангидраза, CAT, SOD, редуктаза MetHb и т.
Следовательно, лечение этими системами потребует многократных или повторных дозировок, что может привести к негативным последствиям нарушения регуляции окислительного стресса и связанной с ним токсичности и иммунного ответа. Следовательно, необходимо тщательно оценить долгосрочный профиль безопасности таких технологий. Инкапсуляция Hb также изучалась в других системах микро- и наночастиц, помимо липидных везикул. В новаторской работе Chang et al. Hb был инкапсулирован в полимерные наночастицы (диаметром 80–200 нм), изготовленные из PEG-PLA и аналогичных блок-сополимеров (119, 120).Эти полимерные наночастицы могут обеспечить кинетику переноса кислорода для гемоглобина на уровне, аналогичном естественным эритроцитам, а полимерный материал может быть спроектирован так, чтобы быть биосовместимым и биоразлагаемым. Кроме того, ферменты, которые поддерживают окислительно-восстановительную среду для стабильности и регуляции функции гемоглобина (например, карбоангидраза, CAT, SOD, редуктаза MetHb и т. д.), также могут быть инкапсулированы в одни и те же наночастицы для дальнейшей имитации действия эритроцитов (121). Этот подход к проектированию также был принят для других полимерных систем, таких как сополимеры поли(ε-капролактон)/поли(L-молочная кислота) (PCL/PLA), поли(L-лизин) (PLL), поли(молочно-гликолевая кислота) кислота) сополимеры (PLGA)/PEG и т.д.(122, 123). Амфифильные блок-сополимерные системы также обеспечивают идеальные строительные блоки для создания полимерных везикул, также известных как полимерсомы, аналогичные липосомам. Эти полимерсомные системы недавно были использованы для создания инкапсулированных в полимеросомы систем Hb (PEH) (124). Сообщается, что нагрузка Hb в этих системах PEH составляет от 1 до 2 мг/мл -1 , по сравнению с концентрацией в крови человека (т.е. в эритроцитах) ~ 150 мг мл -1 . Использование системы экструзии мембран на основе полых волокон предоставило интересный способ производства этих систем PEH (125).Сообщалось, что эти системы PEH способны инкапсулировать как бычий, так и человеческий гемоглобин, и демонстрируют кинетику кислородного равновесия и другие биофизические параметры, сходные с эритроцитами.
д.), также могут быть инкапсулированы в одни и те же наночастицы для дальнейшей имитации действия эритроцитов (121). Этот подход к проектированию также был принят для других полимерных систем, таких как сополимеры поли(ε-капролактон)/поли(L-молочная кислота) (PCL/PLA), поли(L-лизин) (PLL), поли(молочно-гликолевая кислота) кислота) сополимеры (PLGA)/PEG и т.д.(122, 123). Амфифильные блок-сополимерные системы также обеспечивают идеальные строительные блоки для создания полимерных везикул, также известных как полимерсомы, аналогичные липосомам. Эти полимерсомные системы недавно были использованы для создания инкапсулированных в полимеросомы систем Hb (PEH) (124). Сообщается, что нагрузка Hb в этих системах PEH составляет от 1 до 2 мг/мл -1 , по сравнению с концентрацией в крови человека (т.е. в эритроцитах) ~ 150 мг мл -1 . Использование системы экструзии мембран на основе полых волокон предоставило интересный способ производства этих систем PEH (125).Сообщалось, что эти системы PEH способны инкапсулировать как бычий, так и человеческий гемоглобин, и демонстрируют кинетику кислородного равновесия и другие биофизические параметры, сходные с эритроцитами. Это указывает на значительные перспективы применения таких систем PEH в качестве суррогатов эритроцитов в трансфузионной медицине, но в настоящее время для этих систем доступны очень ограниченные данные оценки in vivo . Потенциальной проблемой полимерсомных систем может быть их более высокая толщина оболочки по сравнению с липосомами, что может привести к более длительному времени диффузии кислорода для насыщения инкапсулированного гемоглобина или его высвобождения из гемоглобина в ткани.Модуляция молекулярной массы полимера оболочки и, следовательно, толщины оболочки может обеспечить уникальный способ воздействия на свойства переноса кислорода системами PEH. Более высокая стабильность полимерсом по сравнению с липосомами как при хранении, так и in vivo также может обеспечить дополнительные преимущества для их использования в качестве суррогатных систем эритроцитов, инкапсулированных Hb. Текущие и будущие исследования с этими системами должны быть направлены на установление согласованности между партиями, оценку показателей стерилизации и стабильности при хранении, определение биоактивности гемоглобина после стерилизации, определение in vivo фармакокинетики и биораспределения , а также терапевтическую оценку на соответствующих моделях животных.
Это указывает на значительные перспективы применения таких систем PEH в качестве суррогатов эритроцитов в трансфузионной медицине, но в настоящее время для этих систем доступны очень ограниченные данные оценки in vivo . Потенциальной проблемой полимерсомных систем может быть их более высокая толщина оболочки по сравнению с липосомами, что может привести к более длительному времени диффузии кислорода для насыщения инкапсулированного гемоглобина или его высвобождения из гемоглобина в ткани.Модуляция молекулярной массы полимера оболочки и, следовательно, толщины оболочки может обеспечить уникальный способ воздействия на свойства переноса кислорода системами PEH. Более высокая стабильность полимерсом по сравнению с липосомами как при хранении, так и in vivo также может обеспечить дополнительные преимущества для их использования в качестве суррогатных систем эритроцитов, инкапсулированных Hb. Текущие и будущие исследования с этими системами должны быть направлены на установление согласованности между партиями, оценку показателей стерилизации и стабильности при хранении, определение биоактивности гемоглобина после стерилизации, определение in vivo фармакокинетики и биораспределения , а также терапевтическую оценку на соответствующих моделях животных. (т.е.г., геморрагический шок, ишемия и др.). показаны некоторые репрезентативные конструкции и компоненты инкапсулированных систем гемоглобина, которые прошли и в настоящее время проходят испытания in vitro и in vivo для применения в качестве носителей кислорода, имитирующих эритроциты.
(т.е.г., геморрагический шок, ишемия и др.). показаны некоторые репрезентативные конструкции и компоненты инкапсулированных систем гемоглобина, которые прошли и в настоящее время проходят испытания in vitro и in vivo для применения в качестве носителей кислорода, имитирующих эритроциты.
Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
Новые молекулы и конструкции, включающие Hb в виде O
2 носитель — В этом разделе не проводится различие между «химически модифицированными» и «инкапсулированными» системами Hb, а основное внимание уделяется обзору некоторых новых новых конструкций и технологий, включающих Hb для транспорта кислорода. В одном интересном подходе вместо гемоглобина проводилось ПЭГ-илирование бычьего карбоксигемоглобина (CO-Hb), и получающаяся в результате система ПЭГ-СО-Hb оценивалась на свойства транспорта кислорода (и транспорта СО) (126–128). Обоснование этого дизайна заключается в том, что, как сообщается, эндогенный CO, продуцируемый активностью гемооксигеназы, может оказывать цитопротекторное и гомеостатическое действие, такое как ингибирование апоптоза и воспаления, а также снижение окислительного стресса и сосудорасширяющей активности (129). Продукт PEG-CO-Hb под коммерческим названием SAN-GUINATE (Prolong Pharmaceuticals, Саут-Плейнфилд, Нью-Джерси, США) прошел доклиническую оценку на моделях мелких животных и проходит клинические испытания при лечении небольших групп пациентов. в области серповидно-клеточной анемии, тромботической тромбоцитопенической пурпуры (ТТП) и ишемии после субарахноидального кровоизлияния, с многообещающим профилем безопасности и параметрами оксигенации.В другом недавнем подходе кластерные структуры сердцевина-оболочка были сформированы путем конъюгации человеческого сывороточного альбумина (HSA) с Hb с использованием поверхностных лизинов Hb, конъюгированных с HSA цистеином-34, с использованием α-сукцинимидил-ε-малеимидного сшивающего агента (130).
Обоснование этого дизайна заключается в том, что, как сообщается, эндогенный CO, продуцируемый активностью гемооксигеназы, может оказывать цитопротекторное и гомеостатическое действие, такое как ингибирование апоптоза и воспаления, а также снижение окислительного стресса и сосудорасширяющей активности (129). Продукт PEG-CO-Hb под коммерческим названием SAN-GUINATE (Prolong Pharmaceuticals, Саут-Плейнфилд, Нью-Джерси, США) прошел доклиническую оценку на моделях мелких животных и проходит клинические испытания при лечении небольших групп пациентов. в области серповидно-клеточной анемии, тромботической тромбоцитопенической пурпуры (ТТП) и ишемии после субарахноидального кровоизлияния, с многообещающим профилем безопасности и параметрами оксигенации.В другом недавнем подходе кластерные структуры сердцевина-оболочка были сформированы путем конъюгации человеческого сывороточного альбумина (HSA) с Hb с использованием поверхностных лизинов Hb, конъюгированных с HSA цистеином-34, с использованием α-сукцинимидил-ε-малеимидного сшивающего агента (130). Сообщается, что эти кластеры Hb-HSA снижают риск быстрого клиренса и экстравазации и, таким образом, улучшают высокую стабильность циркуляции и время пребывания. Недавно сообщалось о дальнейшей модификации этих нанокластеров ядро-оболочка Hb-HSA, когда антиоксидантные ферменты и наночастицы платины были встроены в карманы HSA для защиты Hb (131).Эти конструкции нанокластеров до сих пор были оценены только in vitro на их способность связывать кислород, окислительно-восстановительные свойства и стабильность, что дало многообещающие результаты. Однако для установления применимости этих структур in vivo для применения этих структур необходимы тщательные исследования фармакокинетики in vivo, токсикологии, бираспределения и оксигенации, а также демонстрация композиционной и функциональной согласованности от партии к партии. В другом подходе Hb загружали в микрочастицы путем его соосаждения с карбонатом кальция (CaCO 3 ), с последующим сшиванием глутаровым альдегидом и селективным растворением CaCO 3 , в результате чего количество Hb на микрочастицу было близко к количеству естественных эритроцитов ( 132).
Сообщается, что эти кластеры Hb-HSA снижают риск быстрого клиренса и экстравазации и, таким образом, улучшают высокую стабильность циркуляции и время пребывания. Недавно сообщалось о дальнейшей модификации этих нанокластеров ядро-оболочка Hb-HSA, когда антиоксидантные ферменты и наночастицы платины были встроены в карманы HSA для защиты Hb (131).Эти конструкции нанокластеров до сих пор были оценены только in vitro на их способность связывать кислород, окислительно-восстановительные свойства и стабильность, что дало многообещающие результаты. Однако для установления применимости этих структур in vivo для применения этих структур необходимы тщательные исследования фармакокинетики in vivo, токсикологии, бираспределения и оксигенации, а также демонстрация композиционной и функциональной согласованности от партии к партии. В другом подходе Hb загружали в микрочастицы путем его соосаждения с карбонатом кальция (CaCO 3 ), с последующим сшиванием глутаровым альдегидом и селективным растворением CaCO 3 , в результате чего количество Hb на микрочастицу было близко к количеству естественных эритроцитов ( 132). Эти микрочастицы гемоглобина показали кинетику кислородного равновесия, аналогичную кинетике свободного гемоглобина, но гораздо более продолжительное время циркуляции по сравнению со свободным гемоглобином. Сообщалось об аналогичных микрочастицах Hb, содержащих около 80% Hb по сравнению с природными эритроцитами, где Hb и MnCO 3 были соосаждены, после чего сразу же добавляли человеческий сывороточный альбумин для инкапсуляции и стабилизации частиц (133). Эти частицы показали сниженный риск поглощения NO и связанный с этим эффект на вазоконстрикцию.В еще одном недавнем подходе гемоглобин был ковалентно конъюгирован непосредственно с гидрофобным или гидрофильным доменом блок-сополимеров, и полученные конъюгаты самособирались с образованием мицелл, нагруженных гемоглобином (134, 135). В другом интересном дизайне наночастицы MnCO 3 использовались в качестве шаблонов для послойного осаждения (LBL) сборок гемоглобина и диальдегидгепарина (DHP) с последующим сшиванием для стабилизации слоев и селективного растворения ядра шаблона (136).
Эти микрочастицы гемоглобина показали кинетику кислородного равновесия, аналогичную кинетике свободного гемоглобина, но гораздо более продолжительное время циркуляции по сравнению со свободным гемоглобином. Сообщалось об аналогичных микрочастицах Hb, содержащих около 80% Hb по сравнению с природными эритроцитами, где Hb и MnCO 3 были соосаждены, после чего сразу же добавляли человеческий сывороточный альбумин для инкапсуляции и стабилизации частиц (133). Эти частицы показали сниженный риск поглощения NO и связанный с этим эффект на вазоконстрикцию.В еще одном недавнем подходе гемоглобин был ковалентно конъюгирован непосредственно с гидрофобным или гидрофильным доменом блок-сополимеров, и полученные конъюгаты самособирались с образованием мицелл, нагруженных гемоглобином (134, 135). В другом интересном дизайне наночастицы MnCO 3 использовались в качестве шаблонов для послойного осаждения (LBL) сборок гемоглобина и диальдегидгепарина (DHP) с последующим сшиванием для стабилизации слоев и селективного растворения ядра шаблона (136). ). Подобный подход также использовался для формирования нанотрубок, покрытых L-B-L, где были нанесены чередующиеся слои Hb, DHP и фермента CAT, чтобы создать системы для потенциального применения при лечении окислительного стресса (137).Эти сложные наноструктуры были охарактеризованы in vitro на предмет их морфологии, стабильности, цитотоксичности и, в некоторых случаях, биофункциональности, но о доклинической оценке эффективности переноса кислорода in vivo еще не сообщалось. Еще одним недавним интересным достижением в области новых молекул HBOC является использование внеклеточного гемоглобина с большой молекулярной массой, выделенного из морских беспозвоночных, таких как полихеты кольчатых червей (например, продукт HEMOXYCarrier от Hemarina, Morlaix, France) (138).Доклинические исследования этой уникальной молекулы гемоглобина показали снижение сужения сосудов микроциркуляторного русла и отсутствие значительного влияния на среднее артериальное давление по сравнению с другими HBOC, в которых используется гемоглобин крупного рогатого скота или человека (139).
). Подобный подход также использовался для формирования нанотрубок, покрытых L-B-L, где были нанесены чередующиеся слои Hb, DHP и фермента CAT, чтобы создать системы для потенциального применения при лечении окислительного стресса (137).Эти сложные наноструктуры были охарактеризованы in vitro на предмет их морфологии, стабильности, цитотоксичности и, в некоторых случаях, биофункциональности, но о доклинической оценке эффективности переноса кислорода in vivo еще не сообщалось. Еще одним недавним интересным достижением в области новых молекул HBOC является использование внеклеточного гемоглобина с большой молекулярной массой, выделенного из морских беспозвоночных, таких как полихеты кольчатых червей (например, продукт HEMOXYCarrier от Hemarina, Morlaix, France) (138).Доклинические исследования этой уникальной молекулы гемоглобина показали снижение сужения сосудов микроциркуляторного русла и отсутствие значительного влияния на среднее артериальное давление по сравнению с другими HBOC, в которых используется гемоглобин крупного рогатого скота или человека (139). В настоящее время продолжаются дальнейшие исследования этой системы для установления ее клинического потенциала в качестве терапевтического переносчика кислорода.
В настоящее время продолжаются дальнейшие исследования этой системы для установления ее клинического потенциала в качестве терапевтического переносчика кислорода.
В последние годы некоторые подходы к инкапсуляции гемоглобина также были направлены на адаптацию физико-механических свойств естественных эритроцитов, которые значительно влияют на их биологические функции.Естественные здоровые эритроциты имеют двояковогнутую дисковидную морфологию диаметром ~ 8 мкм и толщиной ~ 2 мкм. Эти эритроциты также обладают высокой гибкостью (модуль Юнга 0,1–0,2 кПа), что позволяет им изменять свою морфологию при прохождении через микроциркуляторное русло (140, 141). Механическая целостность и вязкоупругий характер эритроцитов во время их циклической деформации обеспечиваются двумерной спектриновой сетью, прикрепленной к цитозольной стороне их мембраны. Оксигенированный гемоглобин приводит к тому, что эритроциты обладают значительно большей деформируемостью, чем дезоксигенированный гемоглобин, и это позволяет механически гибким эритроцитам перемещаться по микроциркуляторному руслу для транспортировки кислорода. Размер, форма и гибкость эритроцитов также влияют на их движение и распределение в поле кровотока, где они в основном находятся в центре поля параболического потока в средних и крупных сосудах, в то время как в мелких сосудах и капиллярах эритроциты могут распределяться по всему телу. для эффективного обмена кислорода (142). Эти соображения недавно привели к имитации размера, формы и гибкости эритроцитов на основе биоматериалов в синтетических конструкциях, инкапсулирующих гемоглобин. Например, послойная сборка полиэлектролита использовалась для создания микрочастиц, имитирующих форму и деформируемость естественных эритроцитов (143).В этом подходе Hb и BSA электростатически осаждались на поверхности дискоидных частиц PLGA диаметром ~ 7 мкм и толщиной оболочки 400 нм, а затем ядро PLGA селективно растворялось с получением эритроцитарных частиц, загруженных Hb, которые имеют высокую упругую деформацию. . Подобные гибкие частицы, имитирующие эритроциты, были изготовлены с использованием гидрогелевой системы PEG в подходе литографии с остановкой потока (SFL), где механические свойства полученных частиц можно было контролировать, модулируя плотность сшивания гидрогелевых систем (144).
Размер, форма и гибкость эритроцитов также влияют на их движение и распределение в поле кровотока, где они в основном находятся в центре поля параболического потока в средних и крупных сосудах, в то время как в мелких сосудах и капиллярах эритроциты могут распределяться по всему телу. для эффективного обмена кислорода (142). Эти соображения недавно привели к имитации размера, формы и гибкости эритроцитов на основе биоматериалов в синтетических конструкциях, инкапсулирующих гемоглобин. Например, послойная сборка полиэлектролита использовалась для создания микрочастиц, имитирующих форму и деформируемость естественных эритроцитов (143).В этом подходе Hb и BSA электростатически осаждались на поверхности дискоидных частиц PLGA диаметром ~ 7 мкм и толщиной оболочки 400 нм, а затем ядро PLGA селективно растворялось с получением эритроцитарных частиц, загруженных Hb, которые имеют высокую упругую деформацию. . Подобные гибкие частицы, имитирующие эритроциты, были изготовлены с использованием гидрогелевой системы PEG в подходе литографии с остановкой потока (SFL), где механические свойства полученных частиц можно было контролировать, модулируя плотность сшивания гидрогелевых систем (144). В другом подходе частицы, имитирующие форму эритроцитов, были изготовлены из акрилатных гидрогелей с использованием технологии «репликации частиц в несмачивающих шаблонах» (PRINT) (145). Эти частицы были изготовлены в формах размером от 2 до 3 мкм, так что при гидратации частицы набухали в диски диаметром примерно 6 мкм и высотой примерно 1,5 мкм. Кроме того, эффект мениска форм приводит к тому, что частицы становятся тоньше в середине и утолщаются по краям, что напоминает двояковогнутую морфологию эритроцитов.Морфология и гибкость эритроцитов, имитирующие конструкции частиц, полученные с помощью этих двух методов, продемонстрировали способность к упругой деформации in vitro для транспорта через узкие каналы и контролируемое время жизни циркуляции in vivo в зависимости от их модуля упругости. Хотя сообщалось, что эти частицы способны к инкапсуляции гемоглобина посредством физического захвата или ковалентного связывания, подробные сведения о возможностях транспорта кислорода и связанных с ними применениях для переливания in vivo еще не сообщались.
В другом подходе частицы, имитирующие форму эритроцитов, были изготовлены из акрилатных гидрогелей с использованием технологии «репликации частиц в несмачивающих шаблонах» (PRINT) (145). Эти частицы были изготовлены в формах размером от 2 до 3 мкм, так что при гидратации частицы набухали в диски диаметром примерно 6 мкм и высотой примерно 1,5 мкм. Кроме того, эффект мениска форм приводит к тому, что частицы становятся тоньше в середине и утолщаются по краям, что напоминает двояковогнутую морфологию эритроцитов.Морфология и гибкость эритроцитов, имитирующие конструкции частиц, полученные с помощью этих двух методов, продемонстрировали способность к упругой деформации in vitro для транспорта через узкие каналы и контролируемое время жизни циркуляции in vivo в зависимости от их модуля упругости. Хотя сообщалось, что эти частицы способны к инкапсуляции гемоглобина посредством физического захвата или ковалентного связывания, подробные сведения о возможностях транспорта кислорода и связанных с ними применениях для переливания in vivo еще не сообщались. В другом интересном подходе конструкции актин-гемоглобин, инкапсулированные в липосомы (LEAcHb), были получены с использованием полимеризованного актинового ядра, чтобы имитировать морфологию естественных эритроцитов (146). Хотя эти частицы были намного меньше (~ 136,8 нм), чем эритроциты, двояковогнутая форма вместе с механической опорой мембраны увеличила период полураспада до ~ 72 часов. В естественных эритроцитах отрицательный поверхностный заряд электростатически предотвращает агрегацию эритроцитов на расстоянии 20 нм, и это обоснование привело к некоторым исследованиям по имитации поверхностного заряда, относящегося к эритроцитам, на инкапсулированных гемоглобином наночастицах PEG-PLA (<200 нм в диаметре) с использованием цетилтриметиламмония. бромидные (CTAB) или анионные додецилсульфат натрия (SDS) поверхностно-активные вещества (147).Было обнаружено, что период полураспада катионизированных частиц составляет ~11 часов (в 8 раз больше, чем у необработанных частиц), в то время как анионизированные частицы быстро удаляются, что дает период полураспада <1 часа.
В другом интересном подходе конструкции актин-гемоглобин, инкапсулированные в липосомы (LEAcHb), были получены с использованием полимеризованного актинового ядра, чтобы имитировать морфологию естественных эритроцитов (146). Хотя эти частицы были намного меньше (~ 136,8 нм), чем эритроциты, двояковогнутая форма вместе с механической опорой мембраны увеличила период полураспада до ~ 72 часов. В естественных эритроцитах отрицательный поверхностный заряд электростатически предотвращает агрегацию эритроцитов на расстоянии 20 нм, и это обоснование привело к некоторым исследованиям по имитации поверхностного заряда, относящегося к эритроцитам, на инкапсулированных гемоглобином наночастицах PEG-PLA (<200 нм в диаметре) с использованием цетилтриметиламмония. бромидные (CTAB) или анионные додецилсульфат натрия (SDS) поверхностно-активные вещества (147).Было обнаружено, что период полураспада катионизированных частиц составляет ~11 часов (в 8 раз больше, чем у необработанных частиц), в то время как анионизированные частицы быстро удаляются, что дает период полураспада <1 часа. В еще одном недавнем подходе была разработана новая амфифильная полимерная система с использованием полиэтиленимина (ПЭИ), модифицированного пальмитиновой кислотой, и использовалась для формирования наночастиц тороидальной формы (называемых нанобиалисом, диаметром ~ 200 нм), которые могут инкапсулировать гемоглобин, а также поддерживать окислительно-восстановительная ферментативная среда для активности гемоглобина путем совместной инкапсуляции 2,3-ДФГ и лейкометиленового синего (148).Эти новые Hb-содержащие частицы, называемые эритромерами, продемонстрировали некоторые перспективы переноса кислорода in vivo . Детальные исследования биосовместимости (например, для PEI, которые могут создавать проблемы с цитотоксичностью), продолжительность жизни и стабильность циркуляции, способность Hb-нагрузки и возможности транспорта кислорода и т. д. потребуют дальнейшей оценки для установления клинического потенциала таких дизайнов в качестве суррогатов эритроцитов при переливании. лекарство. показаны схемы этих новых появляющихся конструкций и структур переносчиков кислорода на основе гемоглобина.
В еще одном недавнем подходе была разработана новая амфифильная полимерная система с использованием полиэтиленимина (ПЭИ), модифицированного пальмитиновой кислотой, и использовалась для формирования наночастиц тороидальной формы (называемых нанобиалисом, диаметром ~ 200 нм), которые могут инкапсулировать гемоглобин, а также поддерживать окислительно-восстановительная ферментативная среда для активности гемоглобина путем совместной инкапсуляции 2,3-ДФГ и лейкометиленового синего (148).Эти новые Hb-содержащие частицы, называемые эритромерами, продемонстрировали некоторые перспективы переноса кислорода in vivo . Детальные исследования биосовместимости (например, для PEI, которые могут создавать проблемы с цитотоксичностью), продолжительность жизни и стабильность циркуляции, способность Hb-нагрузки и возможности транспорта кислорода и т. д. потребуют дальнейшей оценки для установления клинического потенциала таких дизайнов в качестве суррогатов эритроцитов при переливании. лекарство. показаны схемы этих новых появляющихся конструкций и структур переносчиков кислорода на основе гемоглобина.
Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
СОВРЕМЕННОЕ СОСТОЯНИЕ И НОВЫЕ МОЛЕКУЛЫ
В суровых условиях поля боя и в отдаленных районах неконтролируемое кровотечение, связанное с травмой, и острая коагулопатия остаются одной из основных причин смертности (1–6).В таких сценариях переливание цельной крови и компонентов крови (например, эритроцитов, тромбоцитов и плазмы) в соответствии с рекомендациями по реанимации с контролем повреждений может значительно снизить заболеваемость и смертность, связанные с травмами (7–9). Однако ограниченная доступность и портативность, особые требования к хранению и высокий риск контаминации этих продуктов крови часто создают серьезные логистические проблемы для их догоспитального применения в военных и гражданских сценариях, для немедленного и длительного лечения в месте повреждения (т.г., в пути) полевой уход (10–17). В настоящее время проводится большой объем исследований, направленных на решение этих проблем и повышение доступности и применимости продуктов донорской крови в полевых условиях (18–21). Параллельно с этим возникла захватывающая область исследований, которая сосредоточена на разработке и оценке полусинтетических или синтетических заменителей продуктов крови, которые можно производить в больших масштабах in vitro (т. е. при достаточной доступности), можно стерилизовать и хранить в небольших объемах. в течение длительных периодов времени при различных температурных диапазонах (т.д., легкая переносимость), могут быть восстановлены и введены «по требованию» в далеко зашедших сценариях (т. е. догоспитальная применимость), могут потенциально избежать необходимости сопоставления типов (универсальное применение с минимальным иммуногенным риском), могут безопасно циркулировать при внутрисосудистом введении без системных рисков и может имитировать, усиливать и усиливать эндогенные механизмы функционирования компонентов крови для смягчения последствий травматического обескровливающего кровотечения (22–24). Эта область исследований развивалась в области функциональной имитации клеточных, а также неклеточных компонентов крови и по-прежнему сосредоточена на решении трансляционных задач в отношении биосовместимости, безопасности, догоспитальной доступности и универсальности.
Исследования по сохранению и транспортировке донорской крови начались во время Первой мировой войны для лечения раненых солдат, а переливание крови стало широко доступным во время Второй мировой войны. С 1950-х годов в Соединенных Штатах было создано несколько банков крови, и донорство крови пропагандировалось как форма гражданской ответственности. Последующая разработка процессов и методологий выделения и хранения различных компонентов крови значительно расширила использование цельной крови и ее компонентов.В настоящее время переливание цельной крови, а также различных изолированных компонентов клинически одобрено для применения при травмах среди гражданского населения и на полях сражений (например, при реанимации с целью контроля повреждений), хирургических вмешательствах (например, при трансплантации), хронических и острых анемиях, а также связанных с заболеванием наркоманиях. индуцированные или врожденные нарушения свертываемости крови (25–32). Переливание эритроцитов имеет клиническое значение для эффективного смягчения геморрагического шока в рамках протокола массивной трансфузии у пациентов с гипоперфузией и критическими уровнями кислорода (33–37).Также было продемонстрировано, что переливание эритроцитарной массы на догоспитальном этапе (если возможно) может значительно улучшить выживаемость пациентов с критическими травмами (38, 39). Такие переливания зависят от продуктов донорских эритроцитов (например, эритроцитарной массы [pRBC]). Однако, по данным Красного Креста, только ~ 40% населения США имеют право сдавать кровь в любой момент времени, и только от 10% до 15% действительно сдают кровь. Кроме того, продукты на основе крови имеют несколько ограниченный срок хранения из-за риска патогенного заражения.В настоящее время срок годности эритроцитов составляет от 20 до 40 дней, тогда как срок хранения суспензий тромбоцитов составляет от 3 до 5 дней при комнатной температуре (40). Кроме того, в эритроцитах (и тромбоцитах) при хранении развиваются повреждения, которые влияют на их стабильность, продолжительность циркуляции in vivo и биоактивные функции (41, 42). Проводятся значительные исследования по увеличению срока годности продуктов крови путем хранения в холодильнике, замораживания, лиофилизации и т. д., а также путем разработки технологий снижения патогенности, таких как ультрафиолетовое облучение на основе псоралена или рибофлавина, обширные серологические исследования. тестирование донорской крови, лейкоредукция и специальные протоколы хранения (13, 19, 31, 43–48).Кроме того, транспортировка продуктов крови, особенно на удаленные поля боевых действий и в гражданские районы, особенно для догоспитального использования в пунктах оказания медицинской помощи, продолжает оставаться серьезной логистической проблемой (14, 17, 49).
Такие проблемы потенциально могут быть решены путем разработки полусинтетических или синтетических заменителей компонентов крови (22, 50, 51). На самом деле, интерес к таким синтетическим заменителям возник во время кризиса ВИЧ 1980-х годов из-за страха перед зараженными продуктами крови (4), и это исследование продолжалось в течение последних нескольких десятилетий, с несколькими разработками и продуктами, которые прошли доклинические и клинические оценки.Однако в настоящее время ни один такой продукт не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для применения человеком в Соединенных Штатах, хотя некоторые продукты были одобрены для использования человеком в Южной Африке и в ветеринарии в Соединенных Штатах. Метаанализ 2008 г. 16 клинических испытаний пяти различных заменителей эритроцитов показал повышенный риск для здоровья у пациентов, получавших такие продукты (52). Несмотря на то, что такой анализ привел к некоторым опасениям в отношении клинической безопасности и полезности этих продуктов, дизайн этого анализа активно обсуждался, и он также направил значительный новый акцент на понимание плюсов и минусов этих продуктов на фундаментальном физиологическом и механистическом уровнях. .С этой целью текущая категоризация таких продуктов была изменена с «заменителей эритроцитов» на «оксигенирующие терапевтические средства», чтобы подчеркнуть важную роль таких продуктов в сценариях, где настоящие эритроциты могут быть недостаточно доступны (например, далеко передовые военные действия). а также при перфузии трансплантируемых органов. В этой связи текущая статья будет посвящена обзору «переносчиков кислорода на основе гемоглобина» (HBOC), всестороннему обсуждению соответствующих конструкций, современного состояния и новых молекул, находящихся в разработке, а также подчеркиванию успехов и проблем.С этой целью будут подчеркнуты репрезентативные доклинические и клинические результаты, но не будут всесторонне обсуждаться результаты in vitro и in vivo отдельных дизайнов.
Функция гемоглобина (Hb) в эритроцитах по транспорту кислорода
В крови основной функцией эритроцитов является транспорт кислорода (O 2 ) и в некоторой степени диоксида углерода в ткани и из них за счет связывания газов в гемоглобин (Hb) в эритроцитах. Среднее количество Hb в эритроцитах взрослого человека (средний корпускулярный гемоглобин [MCH]) составляет от 27 до 31 пикограмм на клетку (~ 250 миллионов молекул Hb).Hb представляет собой тетрамерный белок, состоящий из двух α- и двух β-полипептидных цепей, каждая из которых состоит из железосодержащей гемовой группы, способной связывать одну молекулу кислорода (O 2 ). показывает многомасштабное представление эритроцитов, гемоглобина в эритроцитах и химической структуры железосодержащей «гемовой» группы в гемоглобине. Кинетика связывания O 2 с гемоглобином является положительно кооперативной, так что небольшое изменение парциального давления кислорода по мере того, как кровь движется от легких к тканям (), может привести к большим изменениям связанного (в легких) или высвобожденного (в ткани) кислорода. по Hb, как показано классической сигмоидальной формой кривой равновесия O 2 -связывания (OEC, ) (53, 54).Железо, содержащее O 2 в Hb, находится в восстановленном «железистом» состоянии (Fe 2+ ). Когда Hb окисляется с образованием метгемоглобина (MetHb), железо окисляется до «трехвалентного» состояния (Fe 3+ ), которое не способно связывать кислород (55). По этой причине в естественных эритроцитах механизм переноса кислорода Hb тесно связан с окислительно-восстановительными циклами (например, под действием фермента NAD-цитохром b5 редуктазы), так что Fe 2+ -содержащий Hb может поддерживаться в его O 2 — состояние привязки.Необратимое превращение Hb в MetHb не только угнетает его кислородную способность, но и приводит к нарушению регуляции сосудистого тонуса и воспалительным реакциям. Кроме того, гемоглобин в эритроцитах обладает уникальной способностью претерпевать конформационные изменения, чтобы обеспечить насыщение (загрузку) O 2 в легких (более высокое сродство O 2 ), а затем высвобождение O 2 в тканевых капиллярах (более низкое O 2 сходство). Эта обратимая конформационная регуляция аффинности связывания O 2 с Hb поддерживается аллостерическими эффекторными молекулами, такими как 2,3-дифосфоглицерат (2,3-DPG), который образуется внутри эритроцитов в качестве промежуточного гликолитического соединения.Следовательно, поддержание термодинамических и кинетических характеристик гемоглобина, несущих кислород, поддержание окислительно-восстановительной среды и минимизация необратимого образования MetHb являются одними из важных и сложных соображений дизайна в контексте разработки суррогата эритроцитов на основе гемоглобина (56). В этом контексте важным фактором является поддержание физико-химической стабильности гемоглобина, поскольку вне защитного окружения эритроцитов (т. е. вне клеток или стромы) тетрамер гемоглобина склонен к быстрому распаду на димерные и мономерные белковые единицы, которые в свою очередь приводит к быстрому выведению из кровотока во внесосудистое пространство и почки.Это приводит к очень короткому времени пребывания в циркуляции и повышенному риску нефротоксичности. Hb без стромы также лишен регуляторных ферментов сродства к кислороду, таких как 2,3-DPG, а также защитных антиоксидантных ферментов. В результате такой гемоглобин имеет нарушенную способность оксигенации тканей по сравнению с гемоглобином, инкапсулированным в эритроциты, а также склонен к быстрому необратимому окислению до MetHb, тем самым теряя способность транспортировать кислород. Свободный от стромы гемоглобин также является мощным поглотителем как внутри-, так и внесосудистого оксида азота (NO), который вырабатывается сосудистыми эндотелиальными клетками для врожденной вазодилататорной функции, и это связано с гипертоническими побочными эффектами гемоглобина.Таким образом, обеспечение эффективной оксигенации тканей при поддержании разумного времени циркуляции, минимизация гипертензивных побочных эффектов и предотвращение токсичности, вызванной гемоглобином, являются тремя основными требованиями к конструкции HBOC. В следующих разделах рассматриваются и обсуждаются различные подходы к проектированию, направленные на удовлетворение этих требований.
A, Многомасштабное представление эритроцитов и гемоглобина (Hb), показывающее изображение эритроцитов, полученное с помощью сканирующего электронного микроскопа (СЭМ), с изображением двояковогнутой дисковидной структуры, а также последовательное схематическое изображение структуры эритроцитов, структуры гемоглобина и структуры «гема».B. На нем показана схема движения эритроцитов между легкими (участок насыщения кислородом) и тканью (участок сброса кислорода), а (C) показаны соответствующие характеристики кривой кислородного равновесия (OEC) Hb. RBCs указывает на эритроциты.
Системы переносчиков кислорода (HBOC) на основе Hb
HBOC представляют собой полусинтетические системы, в которых природный Hb используется в качестве переносящего кислород компонента, либо в виде химически модифицированных бесклеточных суспензий, либо конъюгированных и сшитых с полимерами вместе с защитными ферментами, или инкапсулированные в носителях из микро- или наночастиц (51, 57).Hb, используемый в этих системах, обычно получают из устаревших человеческих или бычьих эритроцитов или из рекомбинантных источников (57–63). В случае устаревших человеческих или бычьих эритроцитов Hb выделяют путем лизиса клеток, очищают с помощью стерильной фильтрации и хроматографических методов и стерилизуют (например, при слабом нагревании) (64). Использование бесклеточного гемоглобина имеет преимущество минимальной антигенности и способности более эффективно выводить кислород из плазмы из-за отсутствия помех со стороны клеточной мембраны. Фактически, по сообщениям, в начале 20 века суспензия бесклеточного гемоглобина в растворе Рингера с лактатом использовалась для внутривенного лечения 15 пациентов; однако у большого числа из них развилась нефротоксичность и сердечно-сосудистые осложнения (64).Подобные результаты были также получены в 1950-х годах, когда ВМС США лечили нескольких пациентов с бесклеточным гемоглобином (65). Также было обнаружено, что бесклеточный Hb имеет очень короткое время пребывания в циркуляции, поскольку тетрамер Hb быстро диссоциирует на димерные и мономерные формы, которые могут связываться с иммуноглобулинами плазмы и подвергаться быстрому клиренсу ретикуло-эндотелиальной системой в селезенку и печень, а также как почечный клиренс в почки, что приводит к индуцированной гемоглобином токсичности в этих органах (66, 67). Кроме того, бесклеточный Hb и его диссоциированные производные также могут проникать в субэндотелиальный домен кровеносной системы и быстро связывать NO, что приводит к его превращению в нитрат (реакция диоксигенации) и окси-Hb в Met-Hb (68).NO является естественным сосудорасширяющим средством организма, и, следовательно, удаление NO приводит к вазоконстрикции и сердечно-сосудистым осложнениям. Кроме того, отсутствие 2,3-DPG в бесклеточном гемоглобине может вызвать неестественно высокое сродство к кислороду, что делает проблематичным разгрузку O 2 . Бесклеточный Hb также может изменять осмолярность крови, что приводит к изменению объема крови и связанным с этим побочным эффектам. В целом, по этим причинам бесклеточный гемоглобин человека считается проблематичным для in vivo приложений, несущих кислород.Вместо человеческого гемоглобина исследования также проводились с бычьим гемоглобином, но это также связано с аналогичными проблемами стабильности, экстравазации, удаления NO, почечного клиренса и токсичности. Еще одним интересным способом решения некоторых из этих проблем является разработка рекомбинантного гемоглобина (например, в E coli) , где специфические мутации могут способствовать уменьшению диссоциации и модуляции способности связывания NO, но правильная комбинация мутаций, которые могут привести к идеальный дизайн гемоглобина еще предстоит установить (69–71).Рекомбинантные технологии также значительно дороже по сравнению с человеческим или бычьим Hb. Таким образом, значительный объем исследований был сосредоточен на стабилизации in vivo и функциональной модуляции гемоглобина с использованием химических модификаций, таких как сшивка, полимеризация и конъюгация поверхности макромеров. Целью этих модификаций является уменьшение диссоциации гемоглобина, его экстравазации и почечного клиренса при сохранении приемлемого времени жизни циркуляции и O 2 -транспортной способности.
Химически модифицированные HBOC—
Hb может быть сшит как внутри-, так и межмолекулярно. Например, внутримолекулярное сшивание в человеческом гемоглобине, образованном между двумя его а-субъединицами с помощью ацилирования бис-(3,5-дибромсалицил)фумаратом (также известным как диаспирин), привело к получению продукта под названием HemAssist от Baxter (Чикаго, Иллинойс). 57, 72, 73). Этот продукт показал увеличение времени пребывания в кровотоке до 12 часов по сравнению с <6 часов для немодифицированного гемоглобина, но, к сожалению, перекрестно-сшитый гемоглобин показал 72-процентное увеличение уровня смертности у людей по сравнению с физиологическим раствором, и клинические испытания были прекращены (74). ).Аналогичный подход к перекрестному связыванию α-субъединиц рекомбинантного гемоглобина с использованием глицина привел к получению продукта под названием Optro от Somatogen (Boulder, Colo), но это также привело к повышенному риску остановки сердца и смертности (75–77). Вместо только сайт-специфического внутримолекулярного сшивания, полимеризованный гемоглобин также был создан с использованием бифункциональных сшивающих реагентов, таких как сшивка бычьего гемоглобина на основе глутарового альдегида (например, Hemopure первоначально от Biopure, Кембридж, Массачусетс, теперь HbO 2 Therapeutics). , Содертон, Пенсильвания) или Hb человека (e.g., PolyHeme от Northfield Labs, Эванстон, Иллинойс) и перекрестное связывание гемоглобина человека на основе о-рафинозы (например, продукт HemoLink от Hemosol, Торонто, Онтарио, Канада) (78, 79). Такое сшивание позволяет получить бесклеточный гемоглобин с более высокой молекулярной массой, который сохраняет свойства переноса кислорода, минимизируя при этом диссоциацию и быстрый клиренс гемоглобина. Одной из проблем этих подходов является точное регулирование молекулярной массы полимера, а для обеспечения качества продукта необходимы строгие этапы очистки. Сообщалось, что PolyHeme переходит в фазу III клинических испытаний в Соединенных Штатах для лечения кровопотери, связанной с травмой, и показал снижение потребности в естественных переливаниях крови (77).Клинические испытания HemoPure также показали снижение потребности в дополнительных переливаниях крови при кардиохирургии (80). HemoPure получил клиническое одобрение в Южной Африке для лечения пациентов с острой анемией и проходит фазу III клинических испытаний в США. Аналогичный продукт той же компании (HbO 2 Therapeutics, США) под названием Oxyglobin в настоящее время одобрен в США для ветеринарного применения. Сообщается, что HemoLink также прошел клинические испытания фазы III, но был прекращен в 2003 году, когда у пациентов, получавших лечение, возникли неблагоприятные сердечные события.На самом деле, все эти продукты в своих клинических исследованиях продемонстрировали преходящую гипертензию различной степени, повреждение органов из-за сужения и дисфункции микрососудов, желудочно-кишечные расстройства, нефротоксичность, нейротоксичность и повышенную смертность (80–82).
Вместо внутримолекулярного сшивания и межмолекулярной полимеризации модификация гемоглобина также проводилась с помощью макромерной биоконъюгации для повышения стабильности и времени пребывания в сосудах при одновременном снижении распознавания иммунной системой (83–85).Важные примеры этого подхода можно найти в полиэтиленгликолевой (ПЭГ) модификации Hb (например, продукты Hemospan от Sangart Inc, Сан-Диего, Калифорния, и PEG-Hb от Enzon, South Plainfield, NJ) и поли(оксиэтиленовой) модификации Hb. пиридоксилированный сшитый Hb (например, продукт PHP от Apex Bioscience, Durham, NC). ПЭГ-илированные продукты гемоглобина прошли обширные клинические испытания, и исследования показали риск брадикардии и повышения активности печеночных ферментов поджелудочной железы даже при низких дозах (86).Тем не менее, клинические испытания Фазы I и Фазы II показали, что Гемоспан хорошо переносится людьми для эффективной доставки кислорода, а испытания Фазы III у пациентов ортопедической хирургии проводились в Европе. Испытания показали, что риск сердечно-сосудистых и почечных дисфункций все еще сохраняется при использовании таких химически модифицированных продуктов гемоглобина (87). Такие продукты, как PHP, также указывают на такие риски сердечно-сосудистых и почечных дисфункций. За последние два десятилетия было установлено, что бесклеточный гемоглобин (включая химически модифицированные версии) является мощным поглотителем оксида азота (NO) посредством быстрого необратимого связывания (константа скорости ~ 10 7 М -1 с -1 ), что, в свою очередь, может влиять на тонус системных и легочных сосудов, приводя к вазоконстрикции, гипертензии и снижению сердечного выброса (88, 89).Была предпринята попытка решить эту проблему путем модификации молекулы гемоглобина с целью превращения ее в переносчика NO за счет S-нитрозилирования остатков цистеина в β-субъединицах гемоглобина или придания гемоглобину способности к ферментативному превращению в исходный донор NO в присутствии нитритов. , но пока с ограниченным успехом, in vivo (90). Естественные эритроциты содержат ферменты, такие как каталаза (CAT) и супероксиддисмутаза (SOD), которые помогают смягчить окислительный стресс, возникающий из-за супероксидных фрагментов в поврежденных и ишемизированных тканях.Основываясь на этом обосновании, в интересном подходе эти ферменты были сшиты с полимеризованным Hb с образованием PolyHb-SOD-CAT, что показало комбинированные преимущества длительного времени циркуляции и уменьшения окислительного повреждения (91, 92). Другим интересным подходом является включение регуляторных молекул, таких как 2,3-DPG и метгемоглобинредуктаза, вместе с гемоглобином в соответствующие системы HBOC для предотвращения окисления гемоглобина. В последние годы сообщалось о продукте под названием HemoTech, в котором используется очищенный бычий гемоглобин, поперечно связанный внутримолекулярно с АТФ и межмолекулярно с аденозином, а также конъюгированный с восстановленным глутатионом (GSH) (93).Этот уникальный дизайн позволяет использовать фармакологически активные молекулы (АТФ, аденозин и GSH) в качестве химических модификаторов, где АТФ регулирует тонус сосудов через пуринаргические рецепторы, аденозин противодействует вазоконстрикторным свойствам Hb посредством стимуляции аденозиновых рецепторов, а GSH защищает «гемовые рецепторы». ” из NO и различных активных форм кислорода. Доклинические и ранние клинические исследования показали, что HemoTech действует как эффективный переносчик кислорода при лечении кровопотери, анемии и ишемических сосудистых состояний, и необходимы дальнейшие исследования.Другим полимерным гемоглобином, о котором сообщалось в последние годы, является OxyVita, который производится путем модификации механизма полимеризации с нулевой связью с использованием химии карбодиимидов на бычьем тетрамерном гемоглобине для получения «суперполимерных» макромолекул (94). В еще одном недавнем подходе сообщалось о дизайне наноструктуры полинитроксилированного ПЭГ-илированного гемоглобина (PNPH), названного VitalHeme (SynZyme Technologies LLC, Ирвин, Калифорния), где ПЭГ-илированный гемоглобин ковалентно модифицирован каталитической клеткой NO (95).Сообщается, что эти конструкции обеспечивают более высокую стабильность гемоглобина in vivo и в настоящее время проходят доклинические исследования. показаны некоторые известные конструкции, основанные на химической модификации бесклеточного гемоглобина, которые прошли (или все еще проходят) доклинические и клинические испытания транспорта кислорода. Несмотря на многообещающие доклинические и клинические результаты, многие из химически модифицированных продуктов гемоглобина были отозваны из клинических исследований и прекращены в производстве из-за того, что у них больше клинических рисков, чем пользы, что связано с химической гетерогенностью и переменной стабильностью конечного продукта, субоптимальным временем пребывания в сосудах. , неидеальные возможности кислородной загрузки и разгрузки, быстрое необратимое преобразование в метгемоглобин и усиление проблем с сердечно-сосудистой и почечной дисфункцией.В то время как некоторые из более новых продуктов совершенствуют свой дизайн и обработку для решения этих проблем, параллельное направление исследований было сосредоточено на инкапсулировании гемоглобина в различные микро- и наноносители, чтобы более точно имитировать физиологическое инкапсулированное состояние гемоглобина в организме. эритроциты.
Репрезентативные подходы и схемы проектирования HBOC, основанные на химической модификации (сшивание, модификация поверхности, полимеризация и т. д.) гемоглобина, которые прошли значительную доклиническую и клиническую оценку.Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
Инкапсулированные системы HBOC —
За последние два десятилетия технологии доставки лекарств в виде частиц (микрочастицы и наночастицы) произвели революцию в упаковке и доставке фармацевтических соединений путем их инкапсулирования внутри таких частиц, чтобы защитить их от эффектов, вызванных плазмой, увеличить их время циркуляции и обеспечивают постоянную доступность для клеток, тканей и органов. Эта концепция дизайна также была адаптирована для создания HBOC, которые инкапсулируют Hb в подходящие транспортные средства в виде твердых частиц.Фактически, новаторская концепция и демонстрация «биоискусственных клеток» была представлена еще в 1950-х и 1960-х годах Chang et al. путем инкапсуляции Hb, а также других белков и ферментов в микровезикулы на основе полимерных мембран. Первоначально в качестве мембранного материала использовался коллодий (нитрат целлюлозы), который позже был заменен на биоразлагаемый полиэтиленгликоль-полилактид (PEG-PLA) (96, 97). Эти наполненные гемоглобином микровезикулы, метко названные «гемоглобиновыми тельцами», демонстрируют кривые равновесия кислорода, сходные с эритроцитами, а также допускают коинкапсуляцию и активность ферментов, связанных с эритроцитами, таких как 2,3-дифосфоглицерат (2,3-ДФГ), карбоангидраза, и КПП (98–100).Однако в этих системах серьезной проблемой было быстрое поглощение макрофагами и выведение этих микрометровых везикул из кровотока, что приводило к субоптимальному времени пребывания в кровотоке для применения in vivo . Уменьшение диаметра до ~ 1 мкм лишь незначительно улучшило продолжительность циркуляции, и значительные исследовательские усилия были направлены на дальнейшее улучшение времени пребывания в сосудах путем модификации поверхности везикул липидами и полисахаридами. В другом подобном подходе к дизайну Djordjevich et al. сообщили об инкапсулировании Hb в липидные везикулы микронного и субмикронного размера (Hb, инкапсулированные в липосомы или LEH), с мембраной, состоящей из фосфолипидов и холестерина (101–103).Этот дизайн по существу имитирует физиологическое состояние Hb в эритроцитах, где он защищен липидной клеточной мембраной, которая сохраняет подходящие окислительно-восстановительные механизмы для функции Hb. Затем последовал ряд вариаций этого дизайна, например, «неогемоциты», «TRM-645 Neo Red Cells» и т. д., где основное внимание уделялось поддержанию одинаковых уровней инкапсуляции гемоглобина, равномерного распределения размеров везикул, минимизации везикул. дестабилизация или слияние с течением времени и повышают стабильность везикул при хранении, сохраняя при этом свойства транспорта кислорода, аналогичные эритроцитам, инкапсулированного гемоглобина (104–106).В 1990-х годах была клинически освоена технология «невидимых липосом», в которой липидные нановезикулы (диаметром 100–200 нм) функционализировались на поверхности полиэтиленгликолем (ПЭГ) для повышения стабильности при хранении, уменьшения опсонизации и предотвращения быстрого поглощения макрофагами. значительно увеличилось время пребывания в циркуляции (107, 108). Следовательно, эта технология была адаптирована для формирования Hb-инкапсулированных PEG-илированных липосомальных везикул (HbV) (109–111). Для получения HbV в качестве основного мембранного фосфолипида использовали 1,2-диоктадекадиеноил-sn-глицеро-3-фосфатидилхолин (ДОДФХ), так что вызванный γ-облучением радиолиз молекул воды в везикулах генерировал гидроксильные (–ОН) радикалы, которые способствовал межмолекулярной полимеризации диеноильных групп с получением высокостабильных липосом, которые могли выдерживать процессы замораживания-оттаивания, сушки вымораживанием и регидратации.Дизайн HbV привел к значительному увеличению продолжительности кровообращения (~ 60 часов в некоторых животных моделях), и в последние годы сообщалось о нескольких усовершенствованиях этого дизайна (112–116). Было обнаружено, что кислородтранспортная способность HbV аналогична природным эритроцитам с сопоставимой кинетикой насыщения кислородом и высвобождения. Кроме того, липосомальная инкапсуляция гемоглобина предотвратила его эффект поглощения NO и, таким образом, уменьшила связанные с этим негативные эффекты на сосудистую сеть. Инкапсуляция гемоглобина в липосомальные везикулы также предотвращает гломерулярный клиренс гемоглобина (поскольку липосомы слишком велики для почечного клиренса) и, следовательно, снижает нефротоксичность.Текущий оптимизированный продукт HbV содержит около 30 000 молекул Hb, инкапсулированных в одной ПЭГ-илированной липосомальной везикуле диаметром ~ 250 нм. Для сравнения, естественный эритроцит имеет диаметр ~7 мкм и толщину ~2 мкм и содержит около 250 миллионов молекул гемоглобина. HbV прошли обширную доклиническую оценку на подходящих моделях животных для потенциального использования в качестве суррогата эритроцитов при переливании крови и реанимации для смягчения последствий массивного геморрагического шока и случаев гемодилюции, а также для оксигенации ишемизированных, а также трансплантированных тканей и органов.Эти исследования показали значительные перспективы использования HbV в качестве носителей кислорода, вдохновленных эритроцитами; тем не менее, эти системы все еще могут представлять проблемы широкого распределения размеров носителей, различий в эффективности инкапсуляции Hb, различной фармакокинетики и комплемент-опосредованного иммунного ответа in vivo . Дальнейшие исследования в настоящее время направлены на решение этих вопросов для возможного клинического применения дизайнов HbV, а также других аналогичных дизайнов систем гемоглобина, инкапсулированного в липосомы (LEH), заменителей эритроцитов (112–116).Интересно, что вместо инкапсуляции гемоглобина некоторые недавние исследовательские подходы также пытались инкапсулировать кислород (O 2 ) непосредственно в фосфолипидные микровезикулы (диаметром 2–4 мкм) для доставки O 2 в деоксигенированные эритроциты в кровотоке (117, 118). ). Хотя было обнаружено, что эти наполненные кислородом микропузырьки стабильны в течение нескольких недель при хранении с лишь небольшой степенью потери кислорода, in vivo они имеют очень короткое время жизни в циркуляции (<1 часа).Следовательно, лечение этими системами потребует многократных или повторных дозировок, что может привести к негативным последствиям нарушения регуляции окислительного стресса и связанной с ним токсичности и иммунного ответа. Следовательно, необходимо тщательно оценить долгосрочный профиль безопасности таких технологий. Инкапсуляция Hb также изучалась в других системах микро- и наночастиц, помимо липидных везикул. В новаторской работе Chang et al. Hb был инкапсулирован в полимерные наночастицы (диаметром 80–200 нм), изготовленные из PEG-PLA и аналогичных блок-сополимеров (119, 120).Эти полимерные наночастицы могут обеспечить кинетику переноса кислорода для гемоглобина на уровне, аналогичном естественным эритроцитам, а полимерный материал может быть спроектирован так, чтобы быть биосовместимым и биоразлагаемым. Кроме того, ферменты, которые поддерживают окислительно-восстановительную среду для стабильности и регуляции функции гемоглобина (например, карбоангидраза, CAT, SOD, редуктаза MetHb и т. д.), также могут быть инкапсулированы в одни и те же наночастицы для дальнейшей имитации действия эритроцитов (121). Этот подход к проектированию также был принят для других полимерных систем, таких как сополимеры поли(ε-капролактон)/поли(L-молочная кислота) (PCL/PLA), поли(L-лизин) (PLL), поли(молочно-гликолевая кислота) кислота) сополимеры (PLGA)/PEG и т.д.(122, 123). Амфифильные блок-сополимерные системы также обеспечивают идеальные строительные блоки для создания полимерных везикул, также известных как полимерсомы, аналогичные липосомам. Эти полимерсомные системы недавно были использованы для создания инкапсулированных в полимеросомы систем Hb (PEH) (124). Сообщается, что нагрузка Hb в этих системах PEH составляет от 1 до 2 мг/мл -1 , по сравнению с концентрацией в крови человека (т.е. в эритроцитах) ~ 150 мг мл -1 . Использование системы экструзии мембран на основе полых волокон предоставило интересный способ производства этих систем PEH (125).Сообщалось, что эти системы PEH способны инкапсулировать как бычий, так и человеческий гемоглобин, и демонстрируют кинетику кислородного равновесия и другие биофизические параметры, сходные с эритроцитами. Это указывает на значительные перспективы применения таких систем PEH в качестве суррогатов эритроцитов в трансфузионной медицине, но в настоящее время для этих систем доступны очень ограниченные данные оценки in vivo . Потенциальной проблемой полимерсомных систем может быть их более высокая толщина оболочки по сравнению с липосомами, что может привести к более длительному времени диффузии кислорода для насыщения инкапсулированного гемоглобина или его высвобождения из гемоглобина в ткани.Модуляция молекулярной массы полимера оболочки и, следовательно, толщины оболочки может обеспечить уникальный способ воздействия на свойства переноса кислорода системами PEH. Более высокая стабильность полимерсом по сравнению с липосомами как при хранении, так и in vivo также может обеспечить дополнительные преимущества для их использования в качестве суррогатных систем эритроцитов, инкапсулированных Hb. Текущие и будущие исследования с этими системами должны быть направлены на установление согласованности между партиями, оценку показателей стерилизации и стабильности при хранении, определение биоактивности гемоглобина после стерилизации, определение in vivo фармакокинетики и биораспределения , а также терапевтическую оценку на соответствующих моделях животных. (т.е.г., геморрагический шок, ишемия и др.). показаны некоторые репрезентативные конструкции и компоненты инкапсулированных систем гемоглобина, которые прошли и в настоящее время проходят испытания in vitro и in vivo для применения в качестве носителей кислорода, имитирующих эритроциты.
Репрезентативные подходы и схемы дизайна для HBOC, основанные на инкапсулировании Hb в системы микрочастиц и наночастиц, которые прошли значительную доклиническую оценку и имеют клинические перспективы.Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
Новые молекулы и конструкции, включающие Hb в виде O
2 носитель —В этом разделе не проводится различие между «химически модифицированными» и «инкапсулированными» системами Hb, а основное внимание уделяется обзору некоторых новых новых конструкций и технологий, включающих Hb для транспорта кислорода. В одном интересном подходе вместо гемоглобина проводилось ПЭГ-илирование бычьего карбоксигемоглобина (CO-Hb), и получающаяся в результате система ПЭГ-СО-Hb оценивалась на свойства транспорта кислорода (и транспорта СО) (126–128).Обоснование этого дизайна заключается в том, что, как сообщается, эндогенный CO, продуцируемый активностью гемооксигеназы, может оказывать цитопротекторное и гомеостатическое действие, такое как ингибирование апоптоза и воспаления, а также снижение окислительного стресса и сосудорасширяющей активности (129). Продукт PEG-CO-Hb под коммерческим названием SAN-GUINATE (Prolong Pharmaceuticals, Саут-Плейнфилд, Нью-Джерси, США) прошел доклиническую оценку на моделях мелких животных и проходит клинические испытания при лечении небольших групп пациентов. в области серповидно-клеточной анемии, тромботической тромбоцитопенической пурпуры (ТТП) и ишемии после субарахноидального кровоизлияния, с многообещающим профилем безопасности и параметрами оксигенации.В другом недавнем подходе кластерные структуры сердцевина-оболочка были сформированы путем конъюгации человеческого сывороточного альбумина (HSA) с Hb с использованием поверхностных лизинов Hb, конъюгированных с HSA цистеином-34, с использованием α-сукцинимидил-ε-малеимидного сшивающего агента (130). Сообщается, что эти кластеры Hb-HSA снижают риск быстрого клиренса и экстравазации и, таким образом, улучшают высокую стабильность циркуляции и время пребывания. Недавно сообщалось о дальнейшей модификации этих нанокластеров ядро-оболочка Hb-HSA, когда антиоксидантные ферменты и наночастицы платины были встроены в карманы HSA для защиты Hb (131).Эти конструкции нанокластеров до сих пор были оценены только in vitro на их способность связывать кислород, окислительно-восстановительные свойства и стабильность, что дало многообещающие результаты. Однако для установления применимости этих структур in vivo для применения этих структур необходимы тщательные исследования фармакокинетики in vivo, токсикологии, бираспределения и оксигенации, а также демонстрация композиционной и функциональной согласованности от партии к партии. В другом подходе Hb загружали в микрочастицы путем его соосаждения с карбонатом кальция (CaCO 3 ), с последующим сшиванием глутаровым альдегидом и селективным растворением CaCO 3 , в результате чего количество Hb на микрочастицу было близко к количеству естественных эритроцитов ( 132).Эти микрочастицы гемоглобина показали кинетику кислородного равновесия, аналогичную кинетике свободного гемоглобина, но гораздо более продолжительное время циркуляции по сравнению со свободным гемоглобином. Сообщалось об аналогичных микрочастицах Hb, содержащих около 80% Hb по сравнению с природными эритроцитами, где Hb и MnCO 3 были соосаждены, после чего сразу же добавляли человеческий сывороточный альбумин для инкапсуляции и стабилизации частиц (133). Эти частицы показали сниженный риск поглощения NO и связанный с этим эффект на вазоконстрикцию.В еще одном недавнем подходе гемоглобин был ковалентно конъюгирован непосредственно с гидрофобным или гидрофильным доменом блок-сополимеров, и полученные конъюгаты самособирались с образованием мицелл, нагруженных гемоглобином (134, 135). В другом интересном дизайне наночастицы MnCO 3 использовались в качестве шаблонов для послойного осаждения (LBL) сборок гемоглобина и диальдегидгепарина (DHP) с последующим сшиванием для стабилизации слоев и селективного растворения ядра шаблона (136). ). Подобный подход также использовался для формирования нанотрубок, покрытых L-B-L, где были нанесены чередующиеся слои Hb, DHP и фермента CAT, чтобы создать системы для потенциального применения при лечении окислительного стресса (137).Эти сложные наноструктуры были охарактеризованы in vitro на предмет их морфологии, стабильности, цитотоксичности и, в некоторых случаях, биофункциональности, но о доклинической оценке эффективности переноса кислорода in vivo еще не сообщалось. Еще одним недавним интересным достижением в области новых молекул HBOC является использование внеклеточного гемоглобина с большой молекулярной массой, выделенного из морских беспозвоночных, таких как полихеты кольчатых червей (например, продукт HEMOXYCarrier от Hemarina, Morlaix, France) (138).Доклинические исследования этой уникальной молекулы гемоглобина показали снижение сужения сосудов микроциркуляторного русла и отсутствие значительного влияния на среднее артериальное давление по сравнению с другими HBOC, в которых используется гемоглобин крупного рогатого скота или человека (139). В настоящее время продолжаются дальнейшие исследования этой системы для установления ее клинического потенциала в качестве терапевтического переносчика кислорода.
В последние годы некоторые подходы к инкапсуляции гемоглобина также были направлены на адаптацию физико-механических свойств естественных эритроцитов, которые значительно влияют на их биологические функции.Естественные здоровые эритроциты имеют двояковогнутую дисковидную морфологию диаметром ~ 8 мкм и толщиной ~ 2 мкм. Эти эритроциты также обладают высокой гибкостью (модуль Юнга 0,1–0,2 кПа), что позволяет им изменять свою морфологию при прохождении через микроциркуляторное русло (140, 141). Механическая целостность и вязкоупругий характер эритроцитов во время их циклической деформации обеспечиваются двумерной спектриновой сетью, прикрепленной к цитозольной стороне их мембраны. Оксигенированный гемоглобин приводит к тому, что эритроциты обладают значительно большей деформируемостью, чем дезоксигенированный гемоглобин, и это позволяет механически гибким эритроцитам перемещаться по микроциркуляторному руслу для транспортировки кислорода.Размер, форма и гибкость эритроцитов также влияют на их движение и распределение в поле кровотока, где они в основном находятся в центре поля параболического потока в средних и крупных сосудах, в то время как в мелких сосудах и капиллярах эритроциты могут распределяться по всему телу. для эффективного обмена кислорода (142). Эти соображения недавно привели к имитации размера, формы и гибкости эритроцитов на основе биоматериалов в синтетических конструкциях, инкапсулирующих гемоглобин. Например, послойная сборка полиэлектролита использовалась для создания микрочастиц, имитирующих форму и деформируемость естественных эритроцитов (143).В этом подходе Hb и BSA электростатически осаждались на поверхности дискоидных частиц PLGA диаметром ~ 7 мкм и толщиной оболочки 400 нм, а затем ядро PLGA селективно растворялось с получением эритроцитарных частиц, загруженных Hb, которые имеют высокую упругую деформацию. . Подобные гибкие частицы, имитирующие эритроциты, были изготовлены с использованием гидрогелевой системы PEG в подходе литографии с остановкой потока (SFL), где механические свойства полученных частиц можно было контролировать, модулируя плотность сшивания гидрогелевых систем (144).В другом подходе частицы, имитирующие форму эритроцитов, были изготовлены из акрилатных гидрогелей с использованием технологии «репликации частиц в несмачивающих шаблонах» (PRINT) (145). Эти частицы были изготовлены в формах размером от 2 до 3 мкм, так что при гидратации частицы набухали в диски диаметром примерно 6 мкм и высотой примерно 1,5 мкм. Кроме того, эффект мениска форм приводит к тому, что частицы становятся тоньше в середине и утолщаются по краям, что напоминает двояковогнутую морфологию эритроцитов.Морфология и гибкость эритроцитов, имитирующие конструкции частиц, полученные с помощью этих двух методов, продемонстрировали способность к упругой деформации in vitro для транспорта через узкие каналы и контролируемое время жизни циркуляции in vivo в зависимости от их модуля упругости. Хотя сообщалось, что эти частицы способны к инкапсуляции гемоглобина посредством физического захвата или ковалентного связывания, подробные сведения о возможностях транспорта кислорода и связанных с ними применениях для переливания in vivo еще не сообщались.В другом интересном подходе конструкции актин-гемоглобин, инкапсулированные в липосомы (LEAcHb), были получены с использованием полимеризованного актинового ядра, чтобы имитировать морфологию естественных эритроцитов (146). Хотя эти частицы были намного меньше (~ 136,8 нм), чем эритроциты, двояковогнутая форма вместе с механической опорой мембраны увеличила период полураспада до ~ 72 часов. В естественных эритроцитах отрицательный поверхностный заряд электростатически предотвращает агрегацию эритроцитов на расстоянии 20 нм, и это обоснование привело к некоторым исследованиям по имитации поверхностного заряда, относящегося к эритроцитам, на инкапсулированных гемоглобином наночастицах PEG-PLA (<200 нм в диаметре) с использованием цетилтриметиламмония. бромидные (CTAB) или анионные додецилсульфат натрия (SDS) поверхностно-активные вещества (147).Было обнаружено, что период полураспада катионизированных частиц составляет ~11 часов (в 8 раз больше, чем у необработанных частиц), в то время как анионизированные частицы быстро удаляются, что дает период полураспада <1 часа. В еще одном недавнем подходе была разработана новая амфифильная полимерная система с использованием полиэтиленимина (ПЭИ), модифицированного пальмитиновой кислотой, и использовалась для формирования наночастиц тороидальной формы (называемых нанобиалисом, диаметром ~ 200 нм), которые могут инкапсулировать гемоглобин, а также поддерживать окислительно-восстановительная ферментативная среда для активности гемоглобина путем совместной инкапсуляции 2,3-ДФГ и лейкометиленового синего (148).Эти новые Hb-содержащие частицы, называемые эритромерами, продемонстрировали некоторые перспективы переноса кислорода in vivo . Детальные исследования биосовместимости (например, для PEI, которые могут создавать проблемы с цитотоксичностью), продолжительность жизни и стабильность циркуляции, способность Hb-нагрузки и возможности транспорта кислорода и т. д. потребуют дальнейшей оценки для установления клинического потенциала таких дизайнов в качестве суррогатов эритроцитов при переливании. лекарство. показаны схемы этих новых появляющихся конструкций и структур переносчиков кислорода на основе гемоглобина.
Репрезентативные схемы для новых молекул и дизайнов HBOC, включая новые стратегии полимеризации, новые источники гемоглобина и новые стратегии инкапсуляции и биомиметики, которые в настоящее время находятся в стадии разработки и доклинической оценки.Hb обозначает гемоглобин; HBOC, переносчики кислорода на основе Hb.
талассемия | патология | Британика
талассемия , группа заболеваний крови, характеризующихся дефицитом гемоглобина, белка крови, который переносит кислород к тканям.Талассемия (греч. «морская кровь») названа так потому, что впервые была обнаружена среди народов Средиземноморья, среди которых высока заболеваемость ею. Гены талассемии широко распространены в мире, но чаще всего встречаются у людей, чьи предки выходцы из Средиземноморья, Ближнего Востока и Южной Азии. Талассемия также была обнаружена у некоторых северных европейцев и коренных американцев. Среди лиц африканского происхождения заболевание протекает необычно легко. Считается, что потенциально смертельный ген талассемии сохраняется в определенных популяциях, поскольку он обеспечивает некоторую защиту от малярии в гетерозиготном состоянии.
Генетические дефекты талассемии
Гемоглобин состоит из порфиринового соединения (гема) и глобина. Талассемия вызывается генетически детерминированными нарушениями синтеза одной или нескольких полипептидных цепей глобина. Различные формы расстройства отличаются различными комбинациями трех переменных: конкретной полипептидной цепи или цепей, которые поражены; синтезируются ли пораженные цепи в резко сниженных количествах или не синтезируются вовсе; наследуется ли заболевание от одного родителя (гетерозиготно) или от обоих родителей (гомозиготно).
Британская викторина
Болезни, расстройства и многое другое: медицинская викторина
Какое состояние вызывается отложением солей мочевой кислоты? Как по-другому называется лихорадка переломов? Узнайте, что вы знаете о болезнях, расстройствах и многом другом.
Пять различных полипептидных цепей: альфа, α; бета, β; гамма, γ; дельта, δ; и эпсилон, ε.Известно, что ни одно из талассемических расстройств не затрагивает ε-цепь. Вовлечение γ-цепи или δ-цепи встречается редко. Из 19 вариантов наследования талассемии некоторые (например, две гетерозиготные α-талассемии) являются доброкачественными и обычно не проявляют клинических симптомов. Другие формы проявляются легкой анемией, в то время как наиболее тяжелая форма (гомозиготная α-талассемия) обычно вызывает преждевременные роды, либо мертворождение, либо смерть в течение нескольких часов. Считается, что первичная генетическая мутация талассемии приводит к снижению скорости образования α-, β- или δ-цепей, в остальном цепи являются нормальными.Относительная недостаточность одной пары цепей и возникающий в результате дисбаланс пар цепей приводят к неэффективному производству эритроцитов, дефициту образования гемоглобина, микроцитозу (мелкие клетки) и разрушению эритроцитов (гемолиз).
Когда возникают дефекты в синтезе как δ-, так и β-цепи, вызывающие δ-β-талассемию, концентрация типа гемоглобина, известного как Hb F, обычно значительно повышается, поскольку количество β-цепей, доступных для соединения с α-цепями ограничено, и синтез γ-цепи не нарушен.Бета-талассемия составляет большинство всех талассемии. Нарушение производства β-цепей объясняется рядом генетических механизмов, каждый из которых приводит к неадекватному снабжению информационной РНК (мРНК), доступной для правильного синтеза β-цепи на рибосоме (органелле, синтезирующей белок внутри клетки). В некоторых случаях мРНК не образуется. Большинство дефектов связано с продукцией и процессингом РНК из β-гена. При α-талассемии, напротив, делетирован сам ген. В норме имеется две пары α-генов, и тяжесть анемии определяется числом удаленных.Поскольку все нормальные гемоглобины содержат α-цепи, повышения Hb F или Hb A 1 (нормальный взрослый гемоглобин) не происходит. Дополнительные не-α-цепи могут объединяться в тетрамеры с образованием β 4 (гемоглобин H) или γ 4 (гемоглобин Bart). Эти тетрамеры неэффективны в доставке кислорода и нестабильны. Наследование дефицита пары генов от обоих родителей приводит к внутриутробной гибели плода или тяжелому заболеванию новорожденного.
Клинические характеристики талассемии
Эритроциты в этом состоянии необычно плоские с центральными областями окрашивания, и по этой причине их называют клетками-мишенями.При легкой форме заболевания, малой талассемии (гетерозиготная β-талассемия), обычно наблюдается лишь легкая анемия или ее отсутствие, а ожидаемая продолжительность жизни нормальная. Иногда возникают осложнения, связанные с небольшим увеличением селезенки. Большая талассемия (гомозиготная β-талассемия, или анемия Кули) характеризуется тяжелой анемией, увеличением селезенки и деформациями тела, связанными с расширением костного мозга. Последнее, по-видимому, представляет собой ответ на потребность в значительно ускоренном производстве эритроцитов генетически дефектными предшественниками эритроцитов, которые относительно неэффективны в производстве зрелых эритроцитов.Клинические признаки большой талассемии, включая анемию, увеличение селезенки и часто увеличение печени, проявляются через несколько месяцев после рождения. Обычно развиваются инфекции. Примерно в возрасте четырех лет становится очевидной задержка физического роста. У многих пациентов развивается аномально выступающая верхняя челюсть, выступающие скулы и расширение костного мозга в длинных костях, ребрах или позвонках, которые легко ломаются.
Лечение большой талассемии включает переливание крови; однако они имеют лишь временное значение и приводят к избытку железа в тканях после разрушения перелитых эритроцитов.Увеличенная селезенка может еще больше усугубить анемию, собирая и задерживая циркулирующие эритроциты. Спленэктомия может частично облегчить анемию, но не излечивает болезнь.
Эта статья была недавно отредактирована и обновлена Карой Роджерс.Список продуктов, богатых железом
Шпинат, возможно, не даст вам сверхчеловеческой силы для борьбы с такими злодеями, как заклятый враг Попая Блуто, но эта листовая зелень и другие продукты, содержащие железо, могут помочь вам бороться с другим типом врага — железодефицитной анемией.
Железодефицитная анемия, наиболее распространенная форма анемии, представляет собой уменьшение числа эритроцитов, вызванное недостатком железа. Без достаточного количества железа ваше тело не может производить достаточное количество гемоглобина, вещества в красных кровяных тельцах, которое позволяет им переносить кислород к тканям организма. В результате вы можете чувствовать слабость, усталость и раздражительность.
Около 20% женщин, 50% беременных и 3% мужчин не имеют достаточного количества железа в организме. Во многих случаях решение состоит в том, чтобы потреблять больше продуктов с высоким содержанием железа.
Как ваше тело использует железо в пище
Когда вы едите пищу, содержащую железо, железо всасывается в ваш организм в основном через верхнюю часть тонкой кишки.
Существует две формы пищевого железа: гемовая и негемовая. Гемовое железо образуется из гемоглобина. Он содержится в продуктах животного происхождения, изначально содержащих гемоглобин, таких как красное мясо, рыба и птица (мясо, птица и морепродукты содержат как гемовое, так и негемовое железо). Ваше тело поглощает больше всего железа из источников гема. Большая часть негемового железа поступает из растительных источников.
Продукты, богатые железом
Очень хорошие источники гемового железа, содержащие 3,5 миллиграмма или более на порцию, включают: К хорошим источникам гемового железа, содержащим 2,1 миллиграмма или более на порцию, относятся:
- 3 унции вареной говядины
- 3 унции консервированных сардин, консервированных в масле
Другие источники гемового железа, содержащие 0,6 миллиграмма или более на порцию порции, включая:
- 3 унции курицы
- 3 унции вареной индейки
- 3 унции ветчины
- 3 унции телятины
Другие источники гемового железа, с 0.3 миллиграмма или более на порцию, включая:
- 3 унции пикши, окуня, лосося или тунца
Железо в растительных продуктах, таких как чечевица, бобы и шпинат, представляет собой негемовое железо. Это форма железа, добавляемая в обогащенные железом продукты. Наше тело менее эффективно усваивает негемовое железо, но большая часть пищевого железа — это негемовое железо.
Очень хорошие источники негемового железа, содержащие 3,5 мг или более на порцию, включают:
- Сухие завтраки, обогащенные железом
- Одна чашка приготовленных бобов
- Полчашки тофу
Хорошие источники негемового железа , с 2.1 миллиграмм или более на порцию, включая :
- Полстакана консервированной лимской фасоли, красной фасоли или нута
- чашка зародышей пшеницы
- 1 унция семян тыквы, кунжута или тыквы
Другие источники негемового железа, содержащие 0,7 миллиграмма или более, включают: орехи пекан, грецкие орехи, фисташки, жареный миндаль, жареный кешью или семена подсолнечника
Как получить больше железа из пищи od
Некоторые продукты могут помочь вашему организму усваивать железо из продуктов, богатых железом; другие могут этому помешать.Чтобы усвоить больше железа из продуктов, которые вы едите, избегайте употребления кофе или чая, а также продуктов или напитков, богатых кальцием, во время еды, содержащей продукты, богатые железом. Кальций сам по себе может мешать. Чтобы улучшить усвоение железа, ешьте его вместе с хорошими источниками витамина С, такими как апельсиновый сок, брокколи или клубника, или ешьте негемовые железосодержащие продукты с пищей из мяса, рыбы и группа птицы.
Если у вас есть проблемы с получением достаточного количества железа из пищевых источников, вам может потребоваться добавка железа.Но сначала поговорите со своим лечащим врачом о правильной дозировке и тщательно следуйте их инструкциям. Поскольку очень мало железа выводится из организма, железо может накапливаться в тканях и органах тела, когда нормальные места хранения — печень, селезенка и костный мозг — заполнены. Хотя токсичность железа из пищевых источников встречается редко, при приеме добавок возможны смертельные передозировки.


 Принимает участие в синтезе аминокислот. Предупреждает развитие анемии, выкидыши и преждевременные роды. Исключает нарушение умственного развития у детей.
Принимает участие в синтезе аминокислот. Предупреждает развитие анемии, выкидыши и преждевременные роды. Исключает нарушение умственного развития у детей.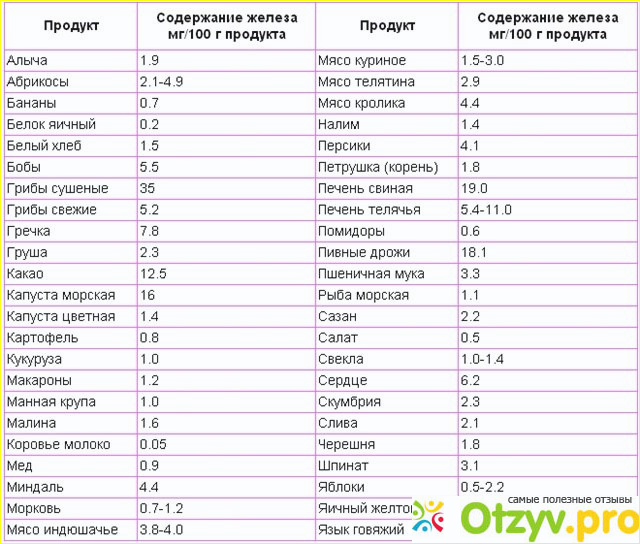

 И.
И.






Добавить комментарий