Гемоглобин содержит: повышенный уровень у женщины, у ребенка, у мужчины
РазноеСтруктура и функция гемоглобина
Обновлено: 21.10.2022
Гемоглобин – это особый железо-содержащий белок крови сложной структуры, выполняющий в организме крайне важную функцию – газообмен и поддержание за счет этого стабильного обмена веществ.
Гемоглобин — своего рода посредник между тканями и легкими в обмене кислородом и углекислым газом. Для полноценного функционирования организма количество гемоглобина должно стабильным, с размахом колебаний (с учетом возраста и пола).
Увеличение количества гемоглобина, равно как и его уменьшение, приводит к расстройствам обмена веществ, к возникновению заболеваний и патологий.
В составе гемоглобина находится два составных элемента:
- белок глобин, являющийся основой для гемоглобина,
- железо в форме гемма, прикрепленное к определенным зонам белка.
Только в таком виде гемоглобин способен переносить в ткани кислород в виде оксигемоглобина, и уносить от них углекислоту в виде карбоксигемоглобина. Это окрашенные пигменты, оксигемоглобин имеет ярко-алый цвет, а карбоксигемоглобин – вишневый. Этим и обусловлена разница в окраске артериальной венозной крови, артериальная богата кислородом, венозная – углекислотой.
Это окрашенные пигменты, оксигемоглобин имеет ярко-алый цвет, а карбоксигемоглобин – вишневый. Этим и обусловлена разница в окраске артериальной венозной крови, артериальная богата кислородом, венозная – углекислотой.
Обмен газов осуществляется в организме непрерывно, даже малейшее нарушение в системе дыхания или обмена газов немедленно приводит к сбоям в работе всего организма и развитию гипоксии (недостатка кислорода).
Гемоглобин находится внутри эритроцитов (красных кровяных телец), находящихся в крови в строго определенных количествах. При снижении количества эритроцитов закономерно снижается и количество гемоглобина в них.
За поддержание стабильного количества эритроцитов в организме человека отвечает костный мозг, где они образуются, а также селезенка и печень, где отжившие эритроциты разрушаются, а гемоглобин из них утилизируется.
Исследование гемоглобина проводят при общем анализе крови, параллельно изучая количество эритроцитов и их качественные характеристики.
Уровень гемоглобина сам по себе не дает возможности поставить диагноз, но является важной характеристикой нездоровья в организме, и оценивается врачом в сочетании с другими изменениями крови и клиническими симптомами.
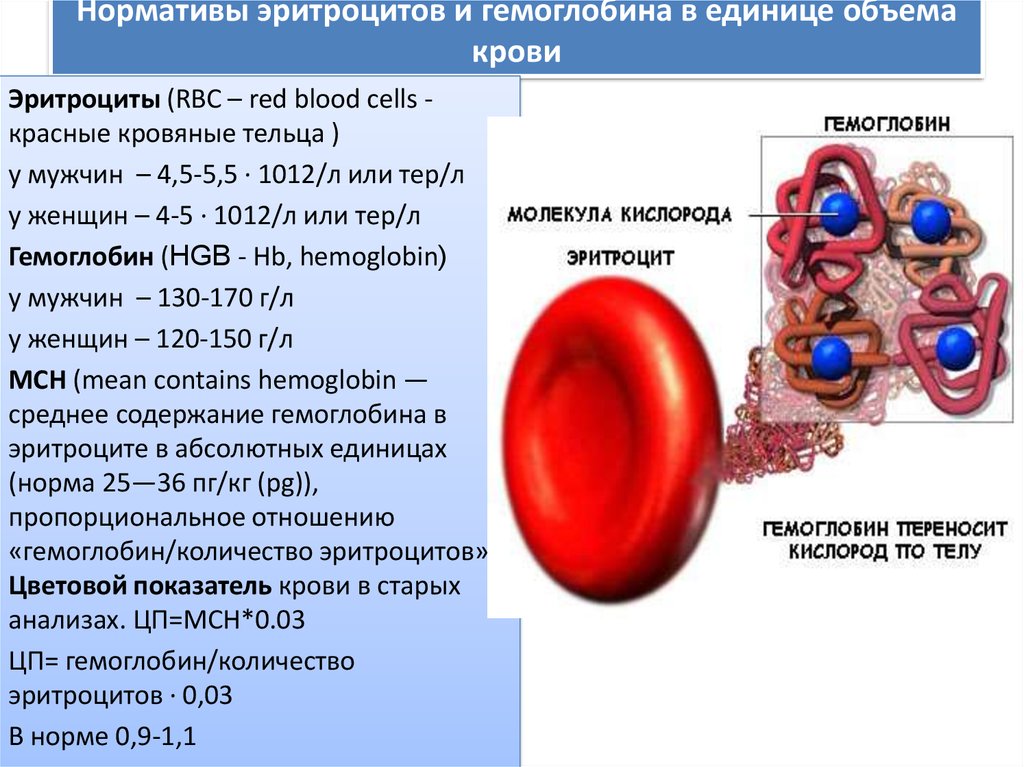
Количество гемоглобина неразрывно связано с количеством эритроцитов, поэтому, нормы эритроцитов составляют:
- для мужчин 4.5-5.5*10 12 /литр,
- для женщин – 3.7-4.6*10 12 /литр.
Количество гемоглобина составляет:
- у мужчин 125-145 г/л,
- у женщин 115-135 г/л.
Гемоглобин у детей
У взрослых в крови циркулирует только взрослая форма гемоглобина. У плода и новорожденных детей из-за особенностей кровообращения существует и особая форма гемоглобина – фетальная. После рождения ребенка она быстро разрушается и замещается на нормальный, взрослый гемоглобин. В норме фетального гемоглобина допускается в крови не более 0.5-1%.
Средняя продолжительность жизни эритроцита – около 120 суток, если жизнеспособность эритроцита уменьшается, это приводит к развитию различных аномалий в виде гемолитических анемий.
Нарушения в структуре гемоглобина
Гемоглобин в результате врожденных или приобретенных аномалий может приобретать неправильные формы или структуру, что отражается на способности эритроцита переносить кислород. Возникают такие нарушения как:
Структура и функция гемоглобина
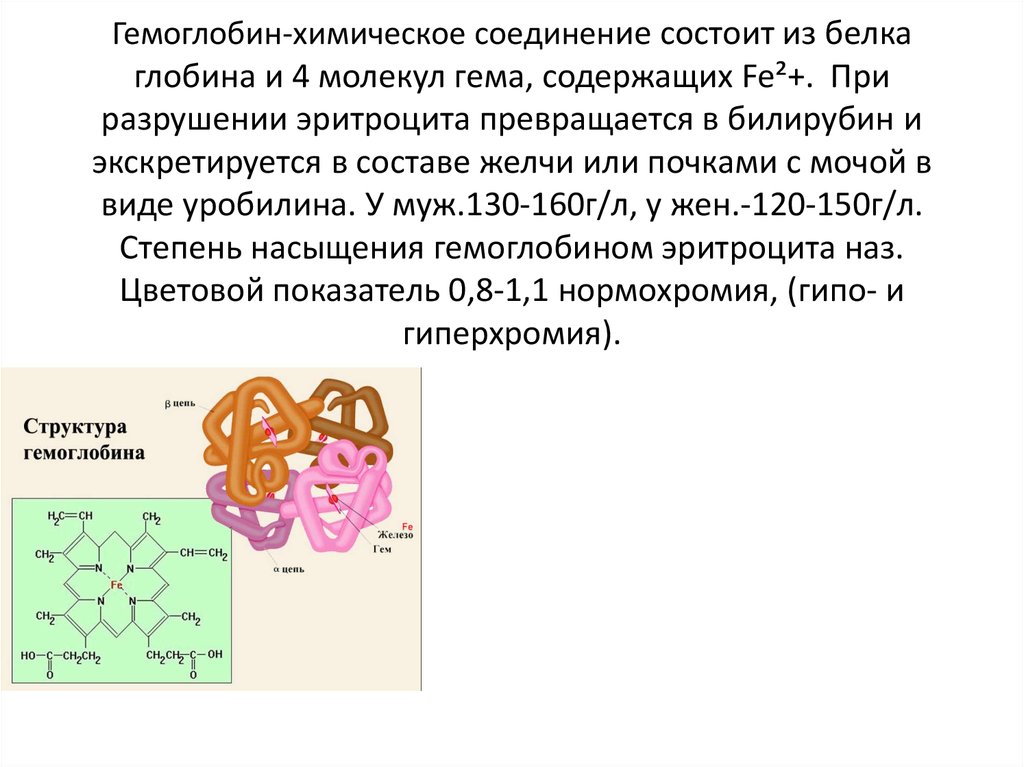
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2.
Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый).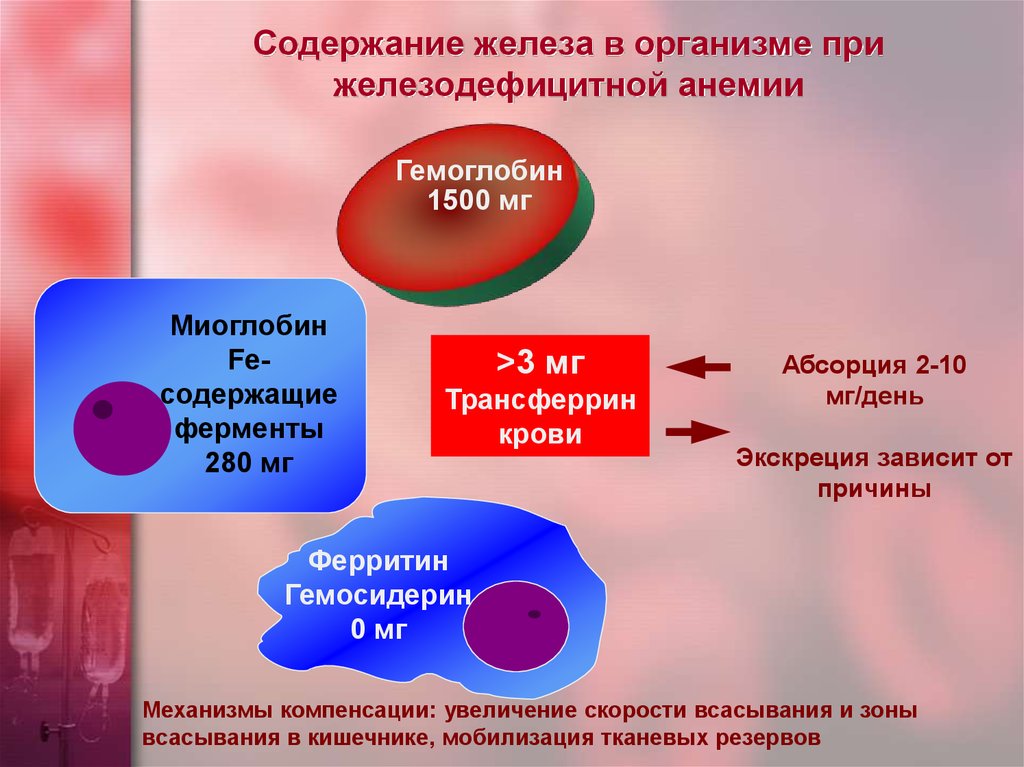 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %.
1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %.
Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина.
Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина.
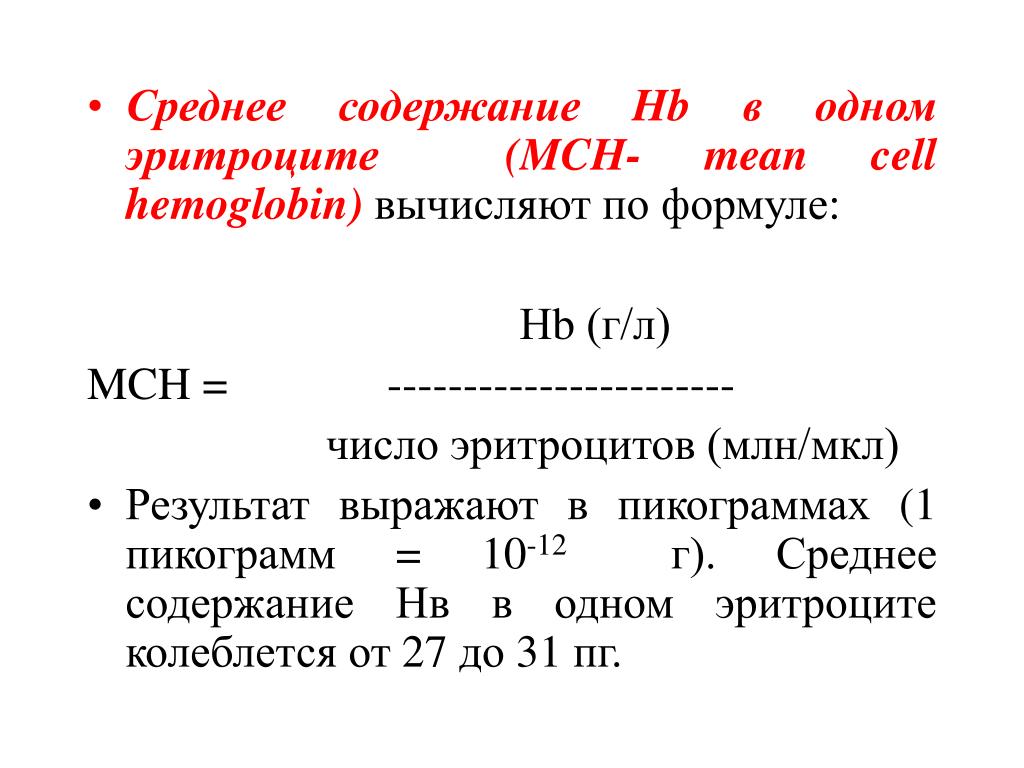
Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии.
Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Болезни гемоглобинов человека, названные гемоглобинопатиями, занимают уникальную позицию в медицинской генетике. Это наиболее частые моногенные болезни у людей, к тому же вызывающие высокую смертность. По оценке Всемирной организации здравоохранения более 5% человеческой популяции — носители мутаций клинически значимых нарушений гемоглобина.
Кроме того, поскольку гемоглобин был одной из первых исследованных белковых структур, а гены глобина у человека стали первыми клонированными генами, связанными с болезнями, их молекулярная и биохимическая патология изучена лучше, чем в любой другой группе генетических болезней. Глобины также проливают свет на процесс как молекулярной, так и популяционной эволюции и служат моделью действия генов в развитии. Прежде чем подробно обсуждать гемоглобинопатии, опишем вкратце нормальное состояние гена глобина и биологию гемоглобина.
Глобины также проливают свет на процесс как молекулярной, так и популяционной эволюции и служат моделью действия генов в развитии. Прежде чем подробно обсуждать гемоглобинопатии, опишем вкратце нормальное состояние гена глобина и биологию гемоглобина.
Гемоглобин — переносчик кислорода в эритроцитах позвоночных. Его молекула содержит четыре субъединицы: две а-цепи и две b-цепи. Каждая субъединица формируется цепью полипептида глобина и простетической группой, гемом, железосодержащим пигментом, соединяющимся с кислородом, придавая молекуле способность транспортировать кислород.
Каждая молекула гемоглобина состоит из двух пар полипептидных цепей разного типа. Цепи глобина в нормальном гемоглобине взрослых, гемоглобине А (НЬА), названы а и b соответственно. Четыре цепи складываются и объединяются, формируя шарообразный тетрамер с молекулярным весом приблизительно 64 500, структуру, обозначаемую для НbА — а2b2. Оба типа цепей почти равны по длине; а-цепь имеет 141 аминокислоту, b-цепь — 146.
Цепи имеют заметное сходство друг с другом в аминокислотной последовательности (первичной структуре) и в трехмерной конфигурации (третичной структуре).
Основные характеристики структуры глобина весьма консервативно сохранялись в ходе эволюции, что стало основой для понимания гемоглобинопатии. Более того, третичная структура полипептида глобина также оказалась в высшей степени консервативной: фактически все изученные глобины имеют семь или восемь извитых участков (в зависимости от цепи). В то же время только две аминокислоты сохраняются во всех глобинах в природе, и неудивительно, что мутации в любом из этих остатков связаны с болезнью.
Исследование структуры гемоглобина позволило предсказать, какие типы мутаций, вероятно, окажутся патогенными. Таким образом, мутации, изменяющие строение глобина, замена высококонсервативной аминокислоты или одного из неполярных остатков, формирующих гидрофобную оболочку, исключающую попадание воды внутрь молекулы, вероятно, вызовут гемоглобинопатию. Как и все белки, глобин имеет «чувствительные области», мутации в которых не могут не влиять на функцию, и «нечувствительные области», мутации в которых переносятся более свободно.
Как и все белки, глобин имеет «чувствительные области», мутации в которых не могут не влиять на функцию, и «нечувствительные области», мутации в которых переносятся более свободно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гемоглобин
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Эффект Бора
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.
Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая.

Другие статьи раздела
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии). Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Mycoplasma pneumoniae — возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
Бактерии – одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
Гипофиз – непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане – гипофизарной ямке турецкого седла. Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
Делеция (ген.) – вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
Механизм обратной связи – система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Гемоглобин. Роль гемоглобина в транспорте кислорода
Обычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином.
а) Обратимая связь кислорода с гемоглобином. Химический состав гемоглобина представлен в отдельных статьях на сайте, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком PO2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком PO2, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани.
Кривая диссоциации оксигемоглобина
1. Кривая диссоциации оксигемоглобина. На рисунке выше приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении PO2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%.
В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%.
В нормальной возвращающейся из периферических тканей венозной крови напряжение О2 составляет около 40 мм рт. ст. и 75% — насыщение гемоглобина кислородом.
2. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15×1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов).
Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода.
3. Количество кислорода, высвобождаемого гемоглобином во время прохождения артериальной крови через ткани. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови (для облегчения понимания просим вас изучить рисунок ниже). При прохождении через капилляры ткани этот объем снижается до 14,4 мл (PO2 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода.
Влияние PO2 крови на количество связанного гемоглобина на 100 мл крови
4. Транспорт кислорода при тяжелой физической нагрузке. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению PO2 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст.
ст.
При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 — 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое.
Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение PO2 в мышечной ткани.
Видео физиология газообмена в легких и транспорта газов кровью — профессор, д.м.
 н. П.Е. Умрюхин
н. П.Е. УмрюхинЧитайте также:
- Поражения глаз динитрофенолом (ДНФ). Динитрофеноловая катаракта
- Случай типичного периостита как исход несвоевременного лечения осложненного кариеса
- Нарушение иннервации при синдроме раздраженного кишечника (СРК)
- Заушная рана. Методы пластики заушной раны
- Патология вестибулярного анализатора. Исследование уха
Гемоглобин
Поиск по сайтуГемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2.
 Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин |
|
Аномальных гемоглобинов более 300, их называют по месту открытия.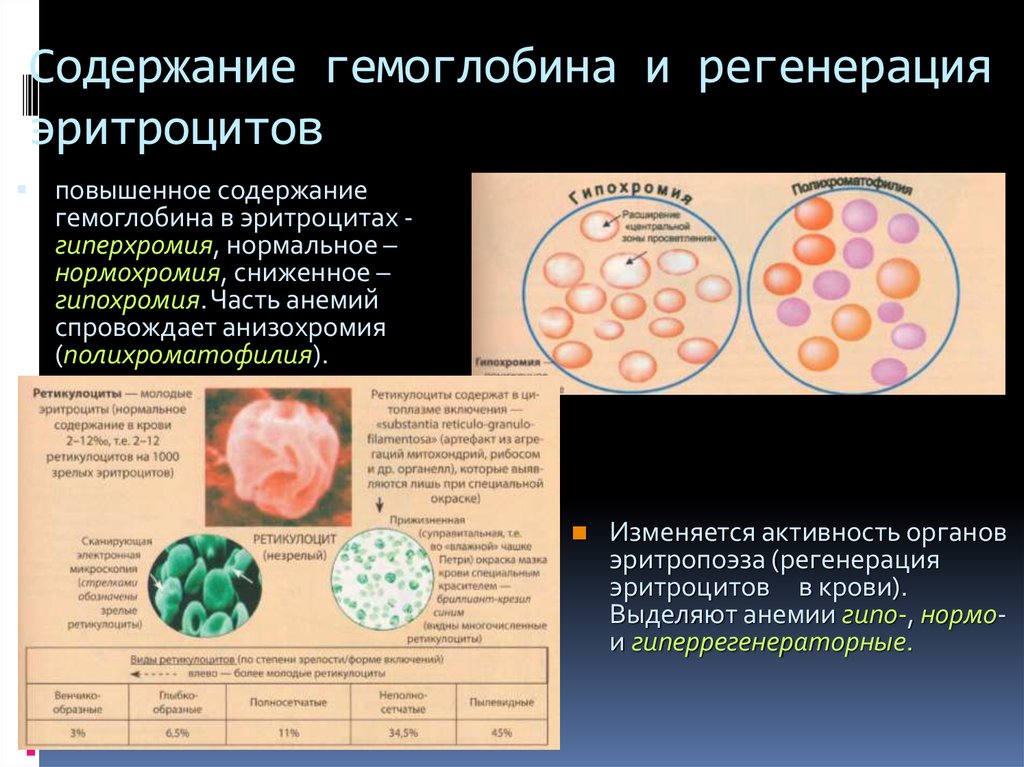
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Как же это происходит? Почему в легких гемоглобин забирает, а в тканях отдает кислород?
Эффект Бора
Эффект был описан датским физиологом Христианом Бором http://en. wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.
Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Заболевания, связанные с изменением количества или структуры гемоглобина
- Повышение уровня гемоглобина наблюдается при эритроцитозах, обезвоживании.
- Снижение уровня гемоглобина наблюдается при различных анемиях.
- При отравлении угарным газом образуется карбгемоглобин (не путайте с карбоксигемоглобином!), который не может присоединять кислород.
- Под действием некоторых веществ образуется метгемоглобин.

- Изменение структуры гемоглобина называется гемоглобинопатией. Самые известные и частые заболевания этой группы – серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. См.гемоглобинопатии на сайте Всемирной организации здравоохранения http://www.who.int/mediacentre/factsheets/fs308/ru/index.html
Знаете ли Вы?
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.
Другие статьи раздела
Chlamydohpila pneumoniae (хламидофила пневмонии), прежнее название Chlamydia pneumoniae
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии).
 Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Mycoplasma pneumoniae (микоплазма пневмонии)
Mycoplasma pneumoniae — возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
Азооспермия
Азооспермия (azoospermia) — отсутствие сперматозоидов в эякуляте
Бактерии
Бактерии – одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
Возбудители заболеваний органов дыхания, частые возбудители пневмонии у детей и взрослых
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
Гипофиз
Гипофиз – непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане – гипофизарной ямке турецкого седла.
 Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.Гирсутизм
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
Гонорея
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
Делеция
Делеция (ген.) – вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
Механизм обратной связи
Механизм обратной связи – система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма.
 Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Все статьи раздела
Материалы по теме
- Трансферрин (определение уровня в крови)
- Железо (Fe) (определение уровня в крови)
- Железодефицитная анемия. Какие анализы сдавать
- Антитела к париетальным клеткам желудка
- Ненасыщенная железосвязывающая способность сыворотки (НЖСС) (определение уровня в крови)
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Фолиевая кислота (определение уровня в крови)
- Витамин В12 (цианкобаламин) (определение уровня в крови)
- Ретикулоциты (определение уровня в крови)
- Процент насыщения трансферрина (железо, трансферрин, НЖСС и процент насыщения трансферрина) (определение в крови)
Структурно-функциональные отношения гемоглобинов человека
1. Перутц М.Ф., Россманн М.Г., Каллис М.Г., Мюрхед Х., Уилл Г., Норт АСТ Структура гемоглобина. Трехмерный синтез Фурье с разрешением 5,5 Å, полученный с помощью рентгеноструктурного анализа. Природа. 1960; (185): 416–422. [PubMed] [Google Scholar]
Перутц М.Ф., Россманн М.Г., Каллис М.Г., Мюрхед Х., Уилл Г., Норт АСТ Структура гемоглобина. Трехмерный синтез Фурье с разрешением 5,5 Å, полученный с помощью рентгеноструктурного анализа. Природа. 1960; (185): 416–422. [PubMed] [Google Scholar]
2. Инграм В.М. Генные мутации гемоглобина человека: химическая разница между нормальным и серповидноклеточным гемоглобином. Природа. 1957; (180): 326–328. [PubMed] [Google Scholar]
3. Эллисон А.С. Защита, обеспечиваемая серповидно-клеточным признаком, против субтертической малярийной инфекции. Бр Мед Дж. 1954;(1):290–294. [PMC бесплатная статья] [PubMed] [Google Scholar]
4. Perutz MF, Lehmann H. Молекулярная патология гемоглобина человека. Природа. 1968; 219(157):902–909. [PubMed] [Google Scholar]
5. Маренго-Роу А. Гемоглобинопатии. Бр Дж Хосп Мед. 1971; 6: 617–630. [Google Scholar]
6. Перуц М.Ф. Белки и нуклеиновые кислоты: структура и функции. Амстердам: Эльзевир; 1962. С. 35–48. [Google Scholar]
7. Конотей-Ахулу ФИД. Наследственные качественные и количественные дефекты эритроцитов в Гане. Историко-географический обзор. Гана Мед Дж. 1968;(7):118–119. [Google Scholar]
Конотей-Ахулу ФИД. Наследственные качественные и количественные дефекты эритроцитов в Гане. Историко-географический обзор. Гана Мед Дж. 1968;(7):118–119. [Google Scholar]
8. Херрик Дж. Б. Своеобразные удлиненные и серповидные эритроциты при тяжелой анемии. Arch Intern Med. 1910;6:517. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Bunn HF. Патогенез и лечение серповидноклеточной анемии. N Engl J Med. 1997;337(11):762–769. [PubMed] [Google Scholar]
10. Рафаэль Р.И. Патофизиология и лечение серповидно-клеточной анемии. Clin Adv Hematol Oncol. 2005;3(6):492–505. [PubMed] [Академия Google]
11. Полинг Л., Итано Х.А., Сингер С.Дж., Уэллс И.С. Серповидноклеточная анемия, молекулярное заболевание. Наука. 1949; (110): 543–548. [PubMed] [Google Scholar]
12. Nagel RL, Platt OS. Общая патофизиология серповидноклеточной анемии. В: Steinberg MH, Forget BG, Higgs DR, редакторы. Нарушения гемоглобина. Кембридж: Издательство Кембриджского университета; 2001. стр. 494–526. [Google Scholar]
стр. 494–526. [Google Scholar]
13. Патаре А., Кинди С.А., Даар С., Деннисон Д. Цитокины при серповидноклеточной анемии. Гематология. 2003;8(5):329–337. [PubMed] [Google Scholar]
14. Hebbel RP, Mohandas N. Клеточная адгезия и микрореология при серповидно-клеточной анемии. В: Steinberg MH, Forget BG, Higgs DR, редакторы. Нарушения гемоглобина. Кембридж: Издательство Кембриджского университета; 2001. стр. 527–549. [Google Scholar]
15. Адамс Р.Дж., Брамбилла Д. Оптимизация первичной профилактики инсульта при серповидноклеточной анемии (СТОП 2). Исследуемые испытания Прекращение профилактических переливаний, используемых для предотвращения инсульта при серповидноклеточной анемии. N Engl J Med. 2005;353(26):2769–2778. [PubMed] [Google Scholar]
16. Marengo-Rowe AJ, Beale D, Lehmann H. Новый вариант гемоглобина человека из южной Аравии: G-Audhali (альфа-23B4 глутаминовая кислота → валин) и вариабельность B4 в гемоглобине человека . Природа. 1968;219(159):1164–1166. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
17. Perutz RR, Ligouri AM, Eirich F. Рентгенологическое исследование и исследование растворимости гемоглобина у пациентов с серповидноклеточной анемией. Природа. 1951; 167 (4258): 929–931. [PubMed] [Google Scholar]
18. Баллас С.К., Смит Э.Д. Изменения эритроцитов во время развития болезненного кризиса серповидноклеточной анемии. Кровь. 1992;79(8):2154–2163. [PubMed] [Google Scholar]
19. Вичинский Е.П. Комплексная помощь при серповидно-клеточной анемии: ее влияние на заболеваемость и смертность. Семин Гематол. 1991;28(3):220–226. [PubMed] [Google Scholar]
20. Национальный институт сердца, легких и крови, Национальный институт здоровья. Лечение серповидноклеточной анемии (публикация NIH № 02-2117). Bethesda, MD: NIH, 2002. Доступно на http://www.nhlbi.nih.gov/health/prof/blood/sickle/; по состоянию на 13 февраля 2006 г.
21. Vermylen C, Cornu G. Трансплантация гемопоэтических стволовых клеток при серповидноклеточной анемии. Карр Опин Гематол. 1997;4(6):377–380. [PubMed] [Google Scholar]
Карр Опин Гематол. 1997;4(6):377–380. [PubMed] [Google Scholar]
22. Steinberg MH, Barton F, Castro O, Pegelow CH, Ballas SK, Kutlar A, Orringer E, Bellevue R, Olivieri N, Eckman J, Varma M, Ramirez G, Adler B, Smith W, Carlos T, Ataga K, DeCastro L, Bigelow C, Saunthararajah Y, Telfer M, Vichinsky E, Claster S, Shurin S, Bridges K, Waclawiw M, Bonds D, Terrin M. Влияние гидроксимочевины на смертность и заболеваемость в Серповидноклеточная анемия взрослых: риски и преимущества до 9лет лечения. ДЖАМА. 2003; 289(13):1645–1651. [PubMed] [Google Scholar]
23. Cokic VP, Smith RD, Beleslin-Cokic BB, Njoroge JM, Miller JL, Gladwin MT, Schechter AN. Гидроксимочевина индуцирует фетальный гемоглобин за счет зависимой от оксида азота активации растворимой гуанилатциклазы. Джей Клин Инвест. 2003;111(2):231–239. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Platt OS, Brambilla DJ, Rosse WF, Milner PF, Castro O, Steinberg MH, Klug PP. Смертность при серповидноклеточной анемии.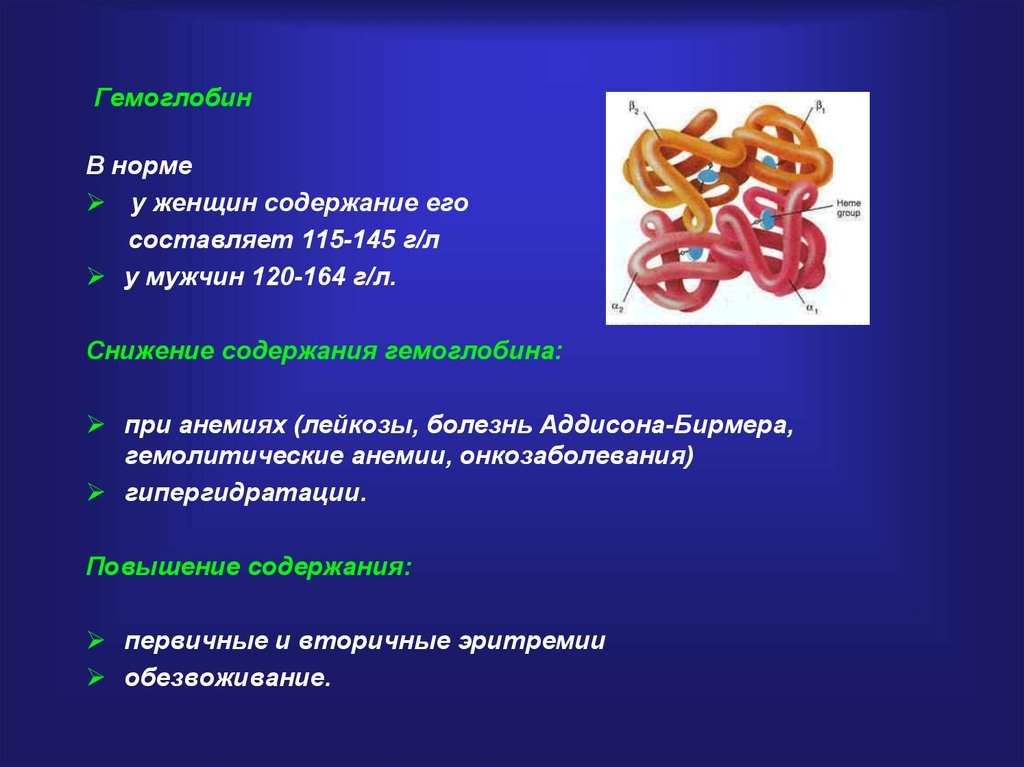 Продолжительность жизни и факторы риска ранней смерти. N Engl J Med. 1994;330(23):1639–1644. [PubMed] [Google Scholar]
Продолжительность жизни и факторы риска ранней смерти. N Engl J Med. 1994;330(23):1639–1644. [PubMed] [Google Scholar]
25. Удани М., Зен К., Коттман М., Леонард Н., Джефферсон С., Деймонт С., Траски Г. Молекула адгезии базальных клеток/лютеранский белок. Рецептор, ответственный за адгезию серповидных клеток к ламинину. Джей Клин Инвест. 1998;101(11):2550–2558. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Ataga KI, Orringer EP. Гиперкоагуляция при серповидно-клеточной анемии: любопытный парадокс. Am J Med. 2003;115(9):721–728. [PubMed] [Google Scholar]
27. Вествик Дж., Уотсон-Уильямс Э.Дж., Кришнамурти С., Маркс Г., Эллис В., Скалли М.Ф., Уайт Дж.М., Каккар В.В. Активация тромбоцитов при стационарной серповидно-клеточной анемии. J Мед. 1983;14(1):17–36. [PubMed] [Google Scholar]
28. Westerman MP, Green D, Gilman-Sachs A, Beaman K, Freels S, Boggio L, Allen S, Zuckerman L, Schlegel R, Williamson P. Антифосфолипидные антитела, белки C и S и изменения коагуляции при серповидно-клеточной анемии.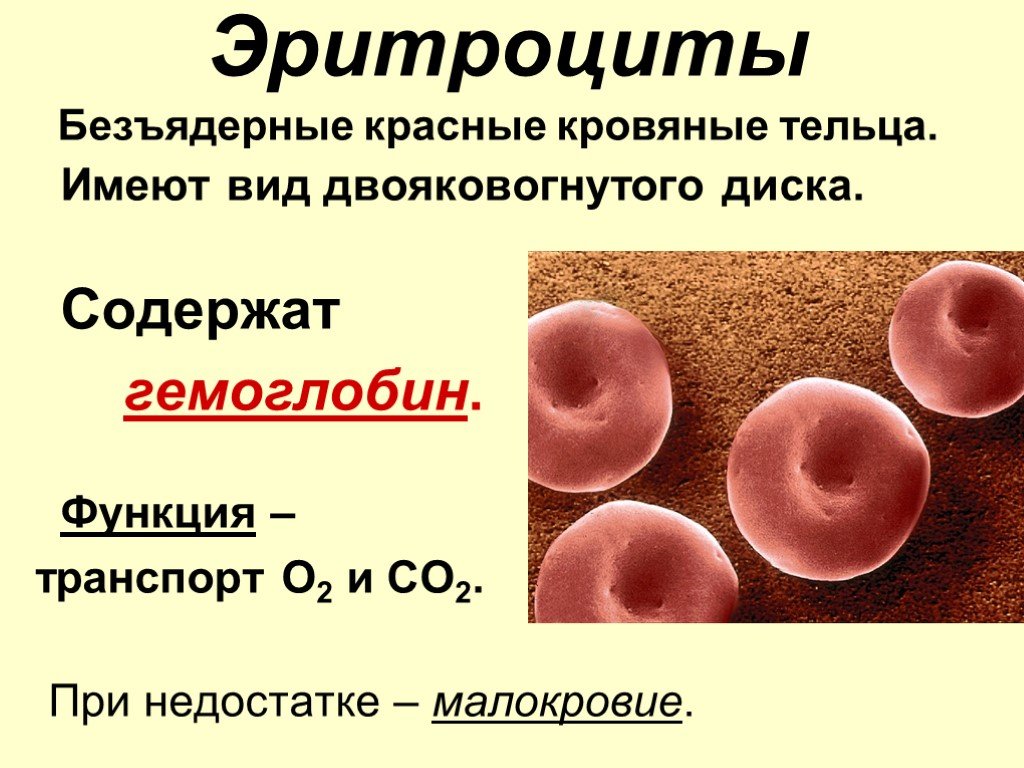 J Lab Clin Med. 1999;134(4):352–362. [PubMed] [Google Scholar]
J Lab Clin Med. 1999;134(4):352–362. [PubMed] [Google Scholar]
29. Фрэнсис Р.Б., мл. Тромбоциты, коагуляция и фибринолиз при серповидно-клеточной анемии: их возможная роль в окклюзии сосудов. Коагуляционный фибринолиз крови. 1991;2(2):341–353. [PubMed] [Google Scholar]
30. Перуц М.Ф. Стереохимия кооперативных эффектов в гемоглобине. Природа. 1970; 228(5273):726–739. [PubMed] [Google Scholar]
31. Перуц М.Ф., Уилкинсон А.Дж., Паоли М., Додсон Г.Г. Новый взгляд на стереохимический механизм кооперативных эффектов в гемоглобине. Annu Rev Biophys Biomol Struct. 1998; (27): 1–34. [PubMed] [Google Scholar]
32. Charache S, Weatherall DJ, Clegg JB. Полицитемия, ассоциированная с гемоглобинопатией. Джей Клин Инвест. 1966;45(6):813–822. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Botha MC, Beale D, Isaacs WA, Lehmann H. Гемоглобин J Кейптаун-альфа-2 92 аргинин заменен глутамином бета-2. Природа. 1966; 212(64):792–795. [PubMed] [Google Scholar]
34. Джонс Р.Т., Осгуд Э.Е., Бримхолл Б., Колер Р.Д. Гемоглобин Якина. I. Клинико-биохимические исследования. Джей Клин Инвест. 1967; 46 (11): 1840–1847. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джонс Р.Т., Осгуд Э.Е., Бримхолл Б., Колер Р.Д. Гемоглобин Якина. I. Клинико-биохимические исследования. Джей Клин Инвест. 1967; 46 (11): 1840–1847. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Lokich JJ, Moloney WC, Bunn HF, Bruckheimer SM, Ranney HM. Гемоглобин Бригама (α 2 A β 2 100 Pro→Leu). Вариант гемоглобина, связанный с семейным эритроцитозом. Джей Клин Инвест. 1973;52(8):2060–2067. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Адамсон Дж. В., Парер Дж. Т., Стаматояннопулос Г. Эритроцитоз, связанный с гемоглобином Ренье: кислородное равновесие и регуляция костного мозга. Джей Клин Инвест. 1969; 48 (8): 1376–1386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Bunn HF, Bradley TB, Davis WE, Drysdale JW, Burke JF, Beck WS, Layer MB. Структурно-функциональные исследования гемоглобина Bethesda (α 2 А β 2 l45His ), вариант, связанный с компенсаторным эритроцитозом. Джей Клин Инвест. 1972; 51 (9): 2299–2309. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест. 1972; 51 (9): 2299–2309. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Дженсен М., Оски Ф.А., Натан Д.Г., Банн Х.Ф. Гемоглобин Syracuse A (α 2 A β 2 143 (h31)His→Pro), новый высокоаффинный вариант, обнаруженный специальными методами электрофореза. Наблюдения за самоокислением нормального и вариантного гемоглобинов. Джей Клин Инвест. 1975;55(3):469–477. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Reissmann KR, Ruth WE, Nomura T. Человеческий гемоглобин с пониженным сродством к кислороду и нарушенными гем-гемовыми взаимодействиями. Джей Клин Инвест. 1961; (40): 1826–1833. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Imamura T, Fujita S, Ohta Y, Hanada M, Yanase T. Гемоглобин Йошизука (G10(108)β-аспарагин→аспарагиновая кислота): новый вариант с пониженное сродство к кислороду из японской семьи. Джей Клин Инвест. 1969;48(12):2341–2348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Имаи К., Моримото Х., Котани М., Шибата С., Мияджи Т. Исследования функции аномальных гемоглобинов. II. Кислородное равновесие аномальных гемоглобинов: Симоносеки, Убэ II, Хикари, Гифу и Агеноги. Биохим Биофиз Акта. 1970; 200(2):197–202. [PubMed] [Google Scholar]
Имаи К., Моримото Х., Котани М., Шибата С., Мияджи Т. Исследования функции аномальных гемоглобинов. II. Кислородное равновесие аномальных гемоглобинов: Симоносеки, Убэ II, Хикари, Гифу и Агеноги. Биохим Биофиз Акта. 1970; 200(2):197–202. [PubMed] [Google Scholar]
42. Каррелл Р.В., Леманн Х., Хатчинсон Х.Е. Гемоглобин Колн (β-98 валин → метионин): нестабильный белок, вызывающий анемию с тельцами включения. Природа. 1966; 210(39):915–916. [PubMed] [Google Scholar]
43. Dacie JV, Shinton NK, Gaffney PJ, Jr, Lehmann H. Гемоглобин Хаммерсмит (бета-42 (CDI) Phe заменен на Ser) Nature. 1967;216(5116):663–665. [PubMed] [Google Scholar]
44. Sakuragawa M, Ohba Y, Miyaji T, Yamamoto K, Miwa S. Японский мальчик с гемолитической анемией из-за нестабильного гемоглобина (Hb Bristol) Nippon Ketsueki Gakkai Zasshi. 1984;47(4):896–902. [PubMed] [Google Scholar]
45. Murari J, Smith LL, Wilson JB, Schneider RG, Huisman TH. Некоторые свойства гемоглобина Ган Хилл. Гемоглобин. 1977;1(3):267–282. [PubMed] [Google Scholar]
1977;1(3):267–282. [PubMed] [Google Scholar]
46. Plaseska D, Dimovski AJ, Wilson JB, Webber BB, Hume HA, Huisman TH. Гемоглобин Монреаль: новый вариант с расширенной бета-цепью из-за делеции Asp, Gly, Leu в положениях 73, 74 и 75 и вставки Ala, Arg, Cys, Gln в том же месте. Кровь. 1991;77(1):178–181. [PubMed] [Google Scholar]
47. Winterbourn CC, Carrell RW. Изучение денатурации гемоглобина и образования телец Гейнца в нестабильных гемоглобинах. Джей Клин Инвест. 1974; 54 (3): 678–689. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Кэти IAB. Явная идиопатическая анемия с тельцами Гейнца. Грейт-Ормонд-стрит, Дж. 1952; (2): 43–48. [Google Scholar]
49. Hörlein H, Weber G. Über Chronishce Familiare Metthämoglobinamie und Eine Modification des Methämoglobins. Dtsch Med Wochenschr. 1948;73:476. [PubMed] [Google Scholar]
50. Джеральд П.С., Эфрон М.Л. Химические исследования нескольких разновидностей Hb, M. Proc Natl Acad Sci U S A. 1961; (47): 1758–1767. [PMC free article] [PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar]
51. Stavem P, Stromme J, Lorkin PA, Lehmann H. Гемоглобин M Saskatoon с легким постоянным гемолизом, заметно усиленным сульфаниламидами. Scand J Haematol. 1972;9(6):566–571. [PubMed] [Google Scholar]
52. Hayashi N, Motokawa Y, Kikuchi G. Исследования взаимосвязи между структурой и функцией гемоглобина M-Iwate. Дж. Биол. Хим. 1966;241(1):79–84. [PubMed] [Google Scholar]
53. Хатт П.Дж., Пишотта А.В., Фэрбенкс В.Ф., Тибодо С.Н., Грин М.М. Анализ последовательности ДНК доказывает, что Hb M-Milwaukee-2 обусловлен кодоном 92 гена бета-глобина (CAC → TAC), предполагаемой мутацией Hb M-Hyde Park и Hb M-Akita. Гемоглобин. 1998;22(1):1–10. [PubMed] [Google Scholar]
54. Хэм Р.Д., Читаят Д., Купер Р., Бэндлер Э., Энг Б., Чуй Д.Х., Уэй Дж.С., Фридман М.Х. Hb FM-Fort Ripley: подтверждение аутосомно-доминантного наследования и диагностика с помощью ПЦР и прямого секвенирования нуклеотидов. Хум Мутат. 1994;3(3):239–242. [PubMed] [Google Scholar]
55. Bauer C, Forster M, Gros G, Mosca A, Perrella M, Rollema HS, Vogel D. Анализ связывания бикарбоната с крокодиловым гемоглобином. Дж. Биол. Хим. 1981;256(16):8429–8435. [PubMed] [Google Scholar]
Bauer C, Forster M, Gros G, Mosca A, Perrella M, Rollema HS, Vogel D. Анализ связывания бикарбоната с крокодиловым гемоглобином. Дж. Биол. Хим. 1981;256(16):8429–8435. [PubMed] [Google Scholar]
56. Komiyama NH, Miyazaki G, Tame J, Nagai K. Трансплантация уникального аллостерического эффекта крокодила в гемоглобин человека. Природа. 1995;373(6511):244–246. [PubMed] [Google Scholar]
Кровь и содержащиеся в ней клетки — группы крови и антигены эритроцитов
У среднего взрослого человека более 5 литров (6 кварт) крови в тело. Кровь переносит кислород и питательные вещества к живым клеткам и забирает их отходы товары. Он также доставляет иммунные клетки для борьбы с инфекциями и содержит тромбоциты. которые могут образовывать пробку в поврежденном кровеносном сосуде, чтобы предотвратить потерю крови.
Через кровеносную систему кровь адаптируется к потребностям организма. Когда вы
тренируясь, ваше сердце качается сильнее и быстрее, чтобы обеспечить больше крови и, следовательно,
кислород к вашим мышцам. Во время инфекции кровь доставляет больше иммунных клеток к
место заражения, где они накапливаются для защиты от вредных захватчиков.
Во время инфекции кровь доставляет больше иммунных клеток к
место заражения, где они накапливаются для защиты от вредных захватчиков.
Все эти функции делают кровь драгоценной жидкостью. Ежегодно в США 30 млн. ед. компонентов крови переливают нуждающимся в них больным. Кровь считается такое драгоценное, что его еще называют «красным золотом», потому что клетки и белки его содержит, может быть продан дороже, чем стоимость того же веса в золоте.
В этой главе представлены компоненты крови.
Кровь содержит клетки, белки и сахара
Если пробирку с кровью оставить для выдерживают полчаса, кровь разделяется на три слоя по мере того, как более плотная компоненты опускаются на дно трубки, а жидкость остается наверху.
Жидкость соломенного цвета, образующая верхний слой, называется плазмой и составляет около 60%
крови. Средний белый слой состоит из лейкоцитов (лейкоцитов) и
тромбоциты, а нижний красный слой — эритроциты (эритроциты). Эти два нижних
слои клеток составляют около 40% крови.
Эти два нижних
слои клеток составляют около 40% крови.
Плазма в основном состоит из воды, но она также содержит много важных веществ, таких как белки (альбумины, факторы свертывания крови, антитела, ферменты и гормоны), сахара (глюкоза) и частицы жира.
Все клетки крови происходят из костного мозга. Они начинают свою жизнь как стволовые клетки, и они созревают в три основных типа клеток — эритроциты, лейкоциты, и тромбоциты. В свою очередь различают три типа лейкоцитов — лимфоциты, моноциты и гранулоциты — и три основных типа гранулоцитов (нейтрофилы, эозинофилы и базофилы). Посмотрите их в действии в разделе «Знакомство с клетками крови».
Коробка
Познакомьтесь с клетками крови.
См. рисунок всех клеточных элементов крови в журнале Janeway & Traver’s Immunobiology.
Образец крови может быть дополнительно разделен на отдельные компоненты путем центрифугирования
образец в центрифуге. Сила вращения заставляет более плотные элементы
сток, а дальнейшая обработка позволяет выделить конкретный белок или
выделение определенного типа клеток крови. С использованием этого метода,
антитела и факторы свертывания могут быть получены из плазмы для лечения иммунных
недостаточность и нарушение свертываемости соответственно. Точно так же можно собирать эритроциты.
для переливания крови.
С использованием этого метода,
антитела и факторы свертывания могут быть получены из плазмы для лечения иммунных
недостаточность и нарушение свертываемости соответственно. Точно так же можно собирать эритроциты.
для переливания крови.
Красные кровяные тельца переносят кислород
Каждую секунду 2-3 миллиона эритроцитов вырабатывается в костном мозге и высвобождается в кровоток. Также известен как эритроциты, эритроциты являются наиболее распространенным типом клеток, обнаруживаемых в крови, причем каждый кубический миллиметр крови, содержащей 4-6 миллионов клеток. Диаметром всего 6 мкм, эритроциты достаточно малы, чтобы протискиваться через мельчайшие кровеносные сосуды. Они циркулируют по телу до 120 дней, после чего старые или поврежденные Эритроциты выводятся из кровотока специализированными клетками (макрофагами) в селезенка и печень.
У человека, как и у всех млекопитающих, в зрелых эритроцитах отсутствует ядро. Это позволяет клетке
больше места для хранения гемоглобина, белка, связывающего кислород, что позволяет эритроцитам
транспортировать больше кислорода. Эритроциты также имеют двояковогнутую форму; эта форма увеличивает их
площадь поверхности для диффузии кислорода через их поверхности. У не млекопитающих
у позвоночных, таких как птицы и рыбы, зрелые эритроциты имеют ядро.
Эритроциты также имеют двояковогнутую форму; эта форма увеличивает их
площадь поверхности для диффузии кислорода через их поверхности. У не млекопитающих
у позвоночных, таких как птицы и рыбы, зрелые эритроциты имеют ядро.
См. электронную микрофотографию эритроцитов в книге Albert’s
Molecular Biology of the Cell.
Если у пациента низкий уровень гемоглобина, состояние, называемое анемией, он может кажутся бледными, потому что гемоглобин придает эритроцитам, а следовательно, и крови их красный цвет. Они также может легко утомляться и чувствовать одышку из-за важной роли гемоглобина в транспортировке кислорода из легких туда, где он необходим. тело.
Лейкоциты являются частью иммунного ответа
Лейкоциты бывают разных форм и размеров. Некоторые клетки имеют ядра с несколькими доли, тогда как другие содержат одно большое круглое ядро. Некоторые содержат пакеты гранулы в их цитоплазме и поэтому известны как гранулоциты.
См. электронную микрофотографию лейкоцитов в книге Albert’s
Molecular Biology of the Cell.
Несмотря на различия во внешнем виде, все различные типы лейкоцитов играют определенную роль. в иммунном ответе. Они циркулируют в крови до тех пор, пока не получат сигнал о том, что часть тела повреждена. Сигналы включают интерлейкин 1 (IL-1), молекулу секретируется макрофагами, что способствует лихорадке при инфекциях, и гистамином, высвобождается циркулирующими базофилами и тучными клетками тканей и способствует аллергические реакции. В ответ на эти сигналы лейкоциты покидают кровеносный сосуд сдавливание через отверстия в стенке кровеносного сосуда. Они мигрируют к источнику сигнализировать и помочь начать процесс заживления.
Люди с низким уровнем лейкоцитов могут иметь более тяжелые инфекции. В зависимости
при отсутствии лейкоцитов пациент подвергается риску различных типов
инфекционное заболевание. Например, макрофаги особенно хорошо поглощают бактерии.
дефицит макрофагов приводит к рецидивирующим бактериальным инфекциям. Напротив, Т
клетки особенно хорошо борются с вирусными инфекциями, и потеря их
Функция приводит к повышенной восприимчивости к вирусным инфекциям.
Нейтрофилы переваривают бактерии
Нейтрофилы также известны как полиморфноядерные клетки, потому что они содержат ядро, форма (морф) которого неправильной формы и содержит много (поли) долей. Они также принадлежат к группе лейкоцитов. называют гранулоцитами, потому что их цитоплазма усеяна гранулами, содержат ферменты, помогающие им переваривать болезнетворные микроорганизмы.
См. нейтрофилы, фагоцитирующие бактерию, в книге Albert’s
Molecular Biology of the Cell.
Моноциты становятся макрофагами
Моноциты представляют собой молодые лейкоциты, циркулировать в крови. Они превращаются в макрофаги после того, как покидают кровь и мигрируют в ткани. Там они обеспечивают немедленную защиту, потому что они могут поглощать (фагоцитировать) и переваривать патогены раньше других типов лейкоцитов. добраться до района.
В печени тканевые макрофаги называются клетками Купфера, и они специализируются на
удаление вредных агентов из крови, вышедшей из кишечника. Альвеолярные макрофаги
находятся в легких и удаляют вредные вещества, которые могли попасть в дыхательные пути.
Макрофаги в селезенке удаляют старые или поврежденные эритроциты и тромбоциты.
из тиража.
Альвеолярные макрофаги
находятся в легких и удаляют вредные вещества, которые могли попасть в дыхательные пути.
Макрофаги в селезенке удаляют старые или поврежденные эритроциты и тромбоциты.
из тиража.
См. макрофаг, фагоцитирующий эритроцит в книге Альберта
«Молекулярная биология клетки».
Макрофаги также являются «антигенпрезентирующими клетками», представляющими чужеродные белки (антигены) к другим иммунным клеткам, вызывая иммунный ответ.
Лимфоциты состоят из В-клеток и Т-клеток
Лимфоциты представляют собой круглые клетки, содержат одно крупное круглое ядро. Различают два основных класса клеток, В-клетки, созревающие в костном мозге, и Т-клетки, созревающие в вилочковая железа.
См. электронную микрофотографию В-клеток и Т-клеток в книге Albert’s
Molecular Biology of the Cell.
После активации В-клетки и Т-клетки запускают различные типы иммунных
отклик. Активированные В-клетки, также известные как плазматические клетки, производят большое количество
специфические антитела, которые связываются с агентом, вызвавшим иммунный ответ. Т
клетки, называемые вспомогательными Т-клетками, выделяют химические вещества, которые рекрутируют другие иммунные клетки.
и помогите скоординировать их атаку. Другая группа, называемая цитотоксическими Т-клетками,
атакует инфицированные вирусом клетки.
Т
клетки, называемые вспомогательными Т-клетками, выделяют химические вещества, которые рекрутируют другие иммунные клетки.
и помогите скоординировать их атаку. Другая группа, называемая цитотоксическими Т-клетками,
атакует инфицированные вирусом клетки.
Тромбоциты способствуют свертыванию крови
Тромбоциты неправильной формы фрагменты клеток, которые циркулируют в крови до тех пор, пока они либо не активируются для образуют кровяной сгусток или удаляются селезенкой. Тромбоцитопения – это состояние низкий уровень тромбоцитов и несет повышенный риск кровотечения. И наоборот, высокий уровень тромбоцитов (тромбоцитемия) несет в себе повышенный риск формирования несоответствующие кровяные сгустки. Это может лишить важные органы, такие как сердце и мозг, их кровоснабжение, вызывая сердечные приступы и инсульты, соответственно.
Диаграмма тромбоцитов в учебнике Albert’s
Molecular Biology of the Cell
Как и все клетки крови, тромбоциты происходят из стволовых клеток в костях
костный мозг. Стволовые клетки превращаются в предшественники тромбоцитов (мегакариоциты), которые
«сбросить» тромбоциты в кровь. Там тромбоциты циркулируют около 9 дней.
Если в это время они сталкиваются с поврежденными стенками кровеносных сосудов, они прилипают к
поврежденном участке и активируются, образуя кровяной сгусток. Это затыкает дыру. В противном случае,
в конце жизни они удаляются из кровообращения селезенкой.
При различных заболеваниях, при которых селезенка гиперактивна, напр. ревматоидный
артрите и лейкемии, селезенка удаляет слишком много тромбоцитов, что приводит к увеличению
кровотечение.
Стволовые клетки превращаются в предшественники тромбоцитов (мегакариоциты), которые
«сбросить» тромбоциты в кровь. Там тромбоциты циркулируют около 9 дней.
Если в это время они сталкиваются с поврежденными стенками кровеносных сосудов, они прилипают к
поврежденном участке и активируются, образуя кровяной сгусток. Это затыкает дыру. В противном случае,
в конце жизни они удаляются из кровообращения селезенкой.
При различных заболеваниях, при которых селезенка гиперактивна, напр. ревматоидный
артрите и лейкемии, селезенка удаляет слишком много тромбоцитов, что приводит к увеличению
кровотечение.
Ваш общий анализ крови
Общий анализ крови (CBC) — это простой анализ крови, который обычно заказывают как часть
обычного медицинского освидетельствования. Как следует из названия, это счет
различных типов клеток, обнаруженных в крови. Тест может диагностировать и контролировать многие
различные заболевания, такие как анемия, инфекции, воспалительные заболевания и
злокачественность. дает пример
значения CBC, но обратите внимание, что референтные диапазоны и используемые единицы измерения могут различаться.
в зависимости от лаборатории, проводившей исследование.
дает пример
значения CBC, но обратите внимание, что референтные диапазоны и используемые единицы измерения могут различаться.
в зависимости от лаборатории, проводившей исследование.
Таблица 1
Общий анализ крови.
Подсчет эритроцитов позволяет выявить анемию
ОАК измеряет следующие характеристики эритроцитов:
общее количество гемоглобина (Hb) в крови
количество эритроцитов (эритроцитов) 902 7 902 7 902 403 902 403 средний размер эритроцитов (MCV)
объем эритроцитов, занимаемый в крови (гематокрит)
Общий анализ крови также включает информацию о эритроцитах, которая рассчитывается из других измерения, например, количества (MCH) и концентрации (MCHC) гемоглобина в эритроциты.
Количество эритроцитов и количество гемоглобина в крови ниже у женщин
чем у мужчин. Это происходит из-за менструальной потери крови каждый месяц. Ниже
определенного уровня гемоглобина, говорят, что у пациента анемия, что предполагает
клинически значимое снижение кислородной емкости. Анемия не является
диагноз, а симптом основного заболевания, которое необходимо исследовать.
Анемия не является
диагноз, а симптом основного заболевания, которое необходимо исследовать.
Ключом к разгадке причины анемии является средний размер эритроцитов (средний корпускулярный объем, MCV). Причины высокого MCV включают дефицит B 12 или витамины фолиевой кислоты в рационе. B 12 содержится в красном мясе, поэтому дефицит B 12 особенно часто встречается у вегетарианцев и веганов. И наоборот, фолиевой кислоты много в свежих листовых зеленых овощах, поэтому Дефицит фолиевой кислоты часто встречается у пожилых людей, которые могут плохо питаться.
Анемия с низким MCV встречается часто и может быть результатом наследственных заболеваний крови, таких как как талассемия, но чаще всего вызвана дефицитом железа. Например, женщины репродуктивного возраста могут терять слишком много железа из-за обильных менструаций кровотечения и склонны к этой форме анемии, известной как железодефицитная анемия.
Гематокрит представляет собой процент эритроцитов по отношению к общему объему крови.

Гематокрит измеряет долю крови, состоящую из эритроцитов. Это отражает сочетание общего количества эритроцитов и объема, который они занимать.
Одним из изменений, наблюдаемых во время беременности, является падение гематокрита. Это происходит потому, что хотя продукция эритроцитов существенно не меняется, объем плазмы увеличивается, т. е. эритроциты «разбавляются». Кроме того, низкий гематокрит может отражают снижение продукции эритроцитов костным мозгом. Это может быть связано с заболевания костного мозга (повреждение токсинами или раком) или из-за снижения эритропоэтин, гормон, секретируемый почками, который стимулирует выработку эритроцитов. Снижение числа эритроцитов также может быть результатом сокращения продолжительности жизни эритроцитов (например, хроническое кровотечение).
Высокое значение гематокрита может действительно отражать увеличение доли эритроцитов
(например, повышенный уровень эритропоэтина, связанный с опухолью эритроцитов, называемой
красная полицитемия), или это может отражать снижение плазменного компонента
кровь (например, потеря жидкости у пострадавших от ожогов).
Увеличение числа лейкоцитов при инфекциях и опухолях
Количество лейкоцитов — это количество лейкоцитов, обнаруженных в кровь.
Повышенное количество лейкоцитов чаще всего вызывается инфекциями, такими как инфекция мочевыводящих путей или пневмония. Это также может быть вызвано опухолями WBC, такими как как лейкемия.
Снижение количества лейкоцитов вызвано тем, что костный мозг не может производить лейкоциты или повышенным удалением лейкоцитов из кровотока больной печенью или гиперактивная селезенка. Отказ костного мозга может быть вызван токсинами или нормальные клетки костного мозга замещаются опухолевыми клетками.
Дифференциальная часть WBC в CBC разбивает WBC на пять различных
типы: нейтрофилы, лимфоциты, моноциты, эозинофилы и базофилы. Нахождение
количество лейкоцитов каждого типа дает больше информации о лежащем в их основе
проблема. Например, на ранних стадиях инфекции большая часть увеличения
в лейкоцитах объясняется увеличением нейтрофилов. Как инфекция
продолжается, лимфоциты увеличиваются. Заражение гельминтами может вызвать увеличение
эозинофилов, в то время как аллергические состояния, такие как сенная лихорадка, вызывают увеличение
в базофилах.
Как инфекция
продолжается, лимфоциты увеличиваются. Заражение гельминтами может вызвать увеличение
эозинофилов, в то время как аллергические состояния, такие как сенная лихорадка, вызывают увеличение
в базофилах.
Количество тромбоцитов указывает на вероятность кровотечения или свертывания
В норме один кубический миллиметр крови содержит от 150 000 до 400 000 тромбоциты. Если число падает ниже этого диапазона, неконтролируемое кровотечение становится риск, тогда как превышение верхней границы этого диапазона указывает на риск неконтролируемое свертывание крови.
Гемоглобин связывает кислород
Гемоглобин — белок, переносящий кислород, который содержится во всех эритроцитах. Он поднимает кислород там, где его много (легкие), и выбрасывает кислород там, где он необходим вокруг тела. Гемоглобин также является пигментом, придающим эритроцитам красный цвет.
Гемовые группы и глобины
Как следует из названия, гемоглобин состоит из «гемовых» групп (железосодержащих
кольца) и «глобины» (белки). На самом деле гемоглобин состоит из четырех глобинов.
белки — две альфа-цепи и две бета-цепи — каждая с
гемовая группа. Группа гема содержит один атом железа, и он может связывать один
молекула кислорода. Поскольку каждая молекула гемоглобина содержит четыре глобина,
он может переносить до четырех молекул кислорода.
На самом деле гемоглобин состоит из четырех глобинов.
белки — две альфа-цепи и две бета-цепи — каждая с
гемовая группа. Группа гема содержит один атом железа, и он может связывать один
молекула кислорода. Поскольку каждая молекула гемоглобина содержит четыре глобина,
он может переносить до четырех молекул кислорода.
См. структуру гемоглобина в Альберте
Молекулярная биология клетки
Гемоглобин переносит кислород
В легких молекула гемоглобина окружена высокой концентрацией кислород, следовательно, он связывает кислород. В активных тканях концентрация кислорода ниже, поэтому гемоглобин выделяет кислород.
Такое поведение намного эффективнее, потому что
Связывание гемоглобина с кислородом является «кооперативным». Это означает
что связывание одной молекулы кислорода облегчает связывание
последующие молекулы кислорода. Точно так же освобождение кислорода облегчает
для высвобождения других молекул кислорода. Это означает, что реакция
гемоглобина к кислородным потребностям активных тканей намного быстрее.
Помимо насыщения гемоглобина кислородом, другие факторы, влияющие на готовность гемоглобина связывать кислород, включая pH плазмы, уровень бикарбоната плазмы, и давление кислорода в воздухе (особенно на больших высотах).
Молекула 2,3-дифосфоглицерат (2,3-ДФГ) связывается с гемоглобином и снижает его сродство к кислороду, что способствует выделению кислорода. У лиц, имеющих акклиматизировались к жизни на больших высотах, уровень 2,3-ДФГ в крови увеличивается, что позволяет доставлять больше кислорода к тканям при низком уровне напряжение кислорода.
Фетальный гемоглобин
Фетальный гемоглобин отличается от взрослого гемоглобина тем, что содержит два гамма цепочки вместо двух бета-цепочек. Фетальный гемоглобин связывает кислород с большим большее сродство, чем у взрослого гемоглобина; это преимущество в утробе матери, потому что он позволяет крови плода извлекать кислород из материнской крови, несмотря на его низкую концентрация кислорода.
В норме весь фетальный гемоглобин замещается взрослым гемоглобином ко времени
рождение.
Расщепление гемоглобина
Старые или поврежденные эритроциты удаляются из кровотока макрофагами в селезенке и печени, а содержащийся в них гемоглобин расщепляется на гем и глобин. Белок глобина может быть переработан или расщеплен до его составляющих. аминокислоты, которые могут быть переработаны или метаболизированы. Гем содержит драгоценные железо, которое сохраняется и повторно используется в синтезе новых молекул гемоглобина.
В процессе метаболизма гем превращается в билирубин, желтый пигмент, который может обесцвечивать кожу и склеру глаза, если он накапливается в крови, состояние, известное как желтуха. Вместо этого белок плазмы альбумин связывается с билирубина и переносит его в печень, где он выделяется с желчью, а также способствует окраске фекалий.
Желтуха – одно из осложнений переливания несовместимой крови. Этот
возникает, когда иммунная система реципиента атакует донорские эритроциты как
иностранный. Скорость разрушения эритроцитов и последующего образования билирубина может
превышают способность печени метаболизировать вырабатываемый билирубин.
Гемоглобинопатии
Гемоглобинопатии образуют группу наследственных заболеваний, вызываемых мутации в глобиновых цепях гемоглобина. Серповидноклеточная анемия является наиболее распространены среди них и связаны с мутацией, которая изменяет одну из аминогрупп кислоты в бета-цепи гемоглобина, образуя «хрупкий» гемоглобин. Когда концентрация кислорода низкая, эритроциты имеют тенденцию к деформации и серповидности. в форме. Эти деформированные клетки могут блокировать мелкие кровеносные сосуды и повреждать органы. они поставляют. Это может быть очень болезненно, и если не лечить, серповидно-клеточная анемия кризис может быть фатальным.
Серповидноклеточная анемия в генетике и болезни
Еще одна наследственная анемия, особенно поражающая жителей Средиземноморья
происхождение — талассемия. Нарушение выработки альфа- или бета-глобина
цепи вызывает ряд симптомов, в зависимости от того, сколько копий альфа и
затронуты бета-гены. Некоторые люди могут быть переносчиками заболевания и
не имеют симптомов, тогда как если все копии генов потеряны, болезнь
фатальный.



 Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
 Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Добавить комментарий